Estructura del flagelo bacteriano. La ilustración a la izquierda (Francis et al., 1994), es una reconstrucción promediada en rotación de micrografías de barrido electrónico de cuerpos basales del gancho. Las designaciones de las diversas partes aparecen en la ilustración de la derecha, procedente y adaptada del Grupo de Nanomáquinas Protónicas (Protonic NanoMachine Group) de la Universidad de Osaka.
El designio — ¿mera apariencia?
L
|
A MAYORÍA DE los científicos modernos creen que todos los seres vivos, con todas sus diversas partes y sistemas funcionales, evolucionaron por medio de un proceso de mutaciones al azar y de selección natural a partir de una línea de descendencia común a lo largo de cientos de millones de años. Naturalmente, las famosas observaciones y documentaciones que hizo Darwin de diversos cambios reales a través del tiempo en muchos organismos ayudaron a popularizar este concepto. Desde entonces, las interpretaciones de la columna geológica y del registro fósil, junto con muchos ejemplos modernos de evolución en tiempo real, como la rápida aparición de la resistencia a los antibióticos en las bacterias, parecen confirmar la teoría de la evolución como algo que es «más que una teoría».
Sin embargo, todavía hay aquellos que siguen cuestionando el potencial creativo de un proceso tan carente de propósito. ¿Puede este mecanismo aparentemente simple de mutaciones al azar y la selección natural originar realmente la asombrosa complejidad y diversidad de todos los seres vivientes? Para muchos, las maravillas del mundo natural y del universo, especialmente cuando se trata de los seres vivos, les inspiran tal maravilla que intuyen que tienen que haber sido dispuestas deliberadamente por una inteligencia extraordinariamente brillante —por Dios, o al menos por una inteligencia divina. Consideremos una observación que hace Keiichi Namba (director del programa de un equipo de científicos dedicados a investigar los detalles de las diversas etapas del montaje del flagelo):
Una enorme cantidad de estas macromoléculas desempeñan cada papel precisamente como máquinas diseñadas a propósito y mantienen las complejas actividades del sistema.12
Naturalmente, el contraargumento es que, a pesar de toda su grandeza, el universo y todos los seres vivos manifiestan sólo una «apariencia de designio», cuando en realidad no hubo ningún propósito ni ninguna planificación deliberada en su creación. ¿Cómo se consigue esta creación carente de propósito y no dirigida? Mediante las capacidades creativas de las mutaciones al azar y de la selección natural.
El mecanismo evolutivo
Naturalmente, la pregunta que se suscita es: ¿puede un proceso sin propósito, que no tiene en absoluto ningún fin ni prevé ningún propósito más elevado, realmente producir las maravillas que vemos a todo nuestro alrededor, e incluso dentro de nosotros mismos? Nos dice la ciencia popular que todo tiene que ver con diminutos pasos —con las pequeñas diferencias y cambios que se van acumulando con el tiempo para producir una fantástica variación en la forma y en
El famoso biólogo materialista británico, Richard Dawkins, describe este proceso como «Escalando el Monte Improbable» en un popular libro que lleva este título. En este libro, Dawkins explica que aunque pueda parecer muy improbable que la montaña de complejidad que existe en la actualidad haya surgido gracias a un azar ciego, la evolución no es un proceso de cambio puramente al azar. La evolución emplea azar para crear pequeños pasos, cada uno de los cuales es bien bueno o malo, o neutral, con respecto a la capacidad reproductiva global del organismo. La Naturaleza, por medio de un proceso que se conoce popularmente como la «supervivencia de los más aptos», da una capacidad de reproducción mayor a aquellos organismos que adquieren cambios positivos, y resta capacidad reproductiva a aquellas criaturas que soportan cambios perjudiciales. Es evidente, entonces, que la siguiente generación quedará más poblada por aquellos organismos con los cambios más beneficiosos. De esta manera, los cambios buenos se acumulan con el paso del tiempo en cada generación, y esta montaña de enorme complejidad va siendo escalada paso a paso, uno por uno.
Discontinuidades no beneficiosas
Todo esto parece estar muy bien, y realmente bastante convincente, excepto quizá por un pequeño problema. La selección natural está limitada en cuanto a que solo puede seleccionar de una forma positiva aquellos cambios funcionales que manifiestan una mejora en la función sobre lo que había antes. Pero resulta que muchos cambios mutacionales (esto es, cambios en los códigos genéticos subyacentes del ADN que dictan como se forma un organismo en cada uno de sus detalles) no tienen en absoluto ningún efecto en la función del organismo. Estos cambios, o mutaciones, son designados como «neutros» con respecto a la selección de la función. Incluso existe una «Teoría Neutral de la Evolución», propuesta en tiempos relativamente recientes por Motoo Kimura.
Una diferencia neutra puede ser cuestión de «deletrear» de manera diferente el código para la misma función. Esta diferente grafía sigue resultando en la producción de un resultado idéntico, igual o equivalente (como acabo de hacer yo al usar tres palabras diferentes que son prácticamente sinónimas). O bien, puede que existan diferencias neutras entre secuencias igualmente carentes de significado — como la diferencia entre quiziligook y quiziliguck. Ambas carecen igualmente de significado cuando se pronuncian en la mayor parte de situaciones. Por ello, ninguna de las dos podría adquirir una mejor «aptitud» o un mayor significado en un medio determinado que en otro. Es evidente, así, que la selección entre ambas sería idéntica o «neutra» con respecto a la función —es decir, completamente al azar.
¿Por qué debe esto ser un problema para la evolución? La cuestión es que a niveles muy bajos de complejidad funcional (esto es, funciones que precisen de una secuencia muy corta de paisaje genético bien especificada que deba materializarse) la proporción de las secuencias potencialmente benéficas a las secuencias no benéficas es bastante elevada. De modo que la cantidad de diferencias neutras entre una secuencia benéfica y la siguiente secuencia más cercana potencialmente benéfica es relativamente baja.
Por ejemplo, consideremos la siguiente secuencia de vocablos en inglés: cat - hat - bat - bad - big - dig - dog. Es fácil pasar por la secuencia de cada tres caracteres en el sistema de la lengua inglesa, debido a que la relación entre términos con significado y sin significado en el «espacio de secuencia» de secuencias de 3 caracteres es de aproximadamente sólo 1 en 18. Sin embargo, esta relación disminuye espectacularmente, de hecho exponencialmente, con cada incremento en longitud mínima de secuencia. Para un espacio de secuencia de 7 caracteres, la proporción es de alrededor de 1 entre 250.000, y esto sin tener siquiera en cuenta la naturaleza «benéfica» de una secuencia determinada en relación con un medio ambiente o situación particulares. Con todo, las secuencias de 7 caracteres están por lo general muy interconectadas, como una red hecha de estrechos caminos entrelazados que rodean grandes espacios de potenciales secuencias carentes de sentido y no beneficiosas. Sin embargo, la disminución exponencial en la proporción se hace evidente, y sus implicaciones son claras. Para funciones de nivel más y más elevado que necesiten secuencias más y más largas con una buena especificación para codificarlas, la proporción entre secuencias con significado y secuencias sin significado llega a hacerse tan pequeña tan rápidamente que cuando se necesita de más de unas pocas docenas de caracteres los caminos y puentes de interconexión que vinculan diversos grupos de islas de secuencias benéficas comienzan a romperse. A unos niveles sorprendentemente bajos de complejidad funcional este proceso aísla las diminutas islas de secuencias benéficas entre sí hasta tal magnitud que simplemente no hay forma de alcanzar estas diminutas islas separadas excepto atravesando el vacío de secuencias no benéficas mediante un proceso de cambio(s) por puro azar con el transcurso del tiempo.
Con cada larguero adicional al subir por la escala de la complejidad funcional, este vacío se va haciendo más y más amplio, de forma exponencial, hasta que es simplemente imposible de cruzar por más que añadamos billones de billones de años de tiempo medio. La selección natural es sencillamente ciega cuando se trata de salvar tales vacíos. Sin la guía de la selección natural, salvar estos espacios demanda cantidades exorbitantemente mucho mayores aún, por cuanto las secuencias basura no benéficas de espacio de secuencia tienen que ser eliminadas al azar antes que se descubra una secuencia benéfica muy rara por un golpe de increíble fortuna (véase cálculos en el apéndice).
Naturalmente, algunos han sugerido que una sola mutación de inserción, compuesta de la secuencia precisamente idónea de múltiples caracteres, podría cruzar un vacío de consideración entre una isla funcional y otra isla muy alejada. Claro que es cierto, pero el problema aquí es que no servirá cualquier secuencia o inserción de caracteres múltiples. Esta secuencia tiene que ser justamente la idónea para que funcione para muchos tipos de funciones de alto nivel. La probabilidad de que aparezca una secuencia específica de esta clase es tan sumamente remota que estamos hablando de billones de años cuando el vacío llega a tamaños de sólo unas pocas docenas de diferencias de caracteres no beneficiosos. Entonces, incluso si la secuencia necesaria apareciera porque sí en el genoma, se tendría que insertar en el lugar justo y preciso para que funcionase de forma benéfica para una función particular en evolución. La inmensa mayoría de potenciales posiciones de inserción serían perjudiciales o como mucho neutras con respecto a la función global.
Así, queda claro que conseguir «el resultado justo» no es una cuestión sencilla. Como media, se precisaría literalmente de billones de billones de años por pruebas al azar para cruzar vacíos no benéficos relativamente pequeños. Así es, en resumen, como se nos presenta el problema. ¿Y cómo se puede resolver?
El flagelo eucariota
Diversidad flagelar en la especie Euglena
El flagelo eucariota es bastante diferente del flagelo bacteriano o procariótico. Para resaltar las significativas diferencias mecánicas subyacentes, el flagelo eucariota es también designado como un «cilio» o «undulipodio». Lo único que tienen en común los flagelos bacterianos, arqueanos y eucariotas es que proyectan una estructura semejante a la de un látigo desde la célula que se mueve de forma que produce una motilidad útil.
Un flagelo eucariota es un haz de nueve pares fundidos de dobletes de microtúbulos que rodean dos microtúbulos simples centrales. La estructura conocida como «9+2» es característica del núcleo del flagelo eucariota llamado axonema. En la base de un flagelo eucariota hay un cuerpo basal o cinetosoma, que es el centro organizador microtubular para los microtúbulos flagelares (de una longitud de alrededor de 500 nanómetros). Estos cuerpos basales son estructuralmente idénticos a los centriolos. El flagelo está encerrado dentro de la membrana celular de modo que el interior del flagelo es accesible para el citoplasma de la célula. Cada uno de los 9 microtúbulos dobletes externos extiende un par de brazos de dineína (uno interno y otro externo) al microtúbulo adyacente. Estos brazos de dineína producen esta fuerza por hidrólisis del ATP. El axonema flagelar contiene también unos rayos radiales (complejos polipeptídicos que se extienden a partir de cada uno de los 9 dobletes microtubulares externos hacia el par central, con la «cabeza» del rayo dirigido hacia el interior). Se cree que el rayo radial está involucrado en la regulación del movimiento flagelar, aunque su función exacta y su método de acción no se comprenden todavía.
Aunque el flagelo eucariota es evidentemente muy complejo, este ensayo en particular considera el flagelo giratorio bacteriano y su supuesto origen evolutivo.
Secuencia del montaje del conjunto del flagelo bacteriano,
según Keiichi Namba et al. Vea la secuencia de montaje en el video:
Esto plantea un problema potencial para la evolución de sistemas funcionales de gran complejidad, como el sistema motor del flagelo bacteriano (véase la animación de un modelo actual de montaje del flagelo, por Keiichi Namba et al12, que se presenta aquí desglosada en un conjunto de imágenes). Estos sistemas precisan de muchas piezas proteínicas individuales que funcionen de manera concatenada al mismo tiempo en una orientación específica para conseguir una función unida. Si falta cualquiera de estas piezas, o queda alterada hasta más allá de un cierto grado muy limitado, la función global del sistema, en este caso la motilidad, no operará en absoluto, ni con una actividad mínima.
Se debe considerar que el sistema flagelar, en particular, precisa de los servicios de alrededor de 50 genes — incluyendo los genes para el aparato sensorial (que hace girar el flagelo en sentido horario o antihorario a una velocidad mayor o menor dependiendo del ambiente). Todos estos genes han sido descritos de manera detallada. Como mínimo parece que se precisa de 30 tipos de proteínas diferentes (codificadas por los genes) para construir la estructura efectiva, y alrededor de otras 20 para ayudar en la construcción, regulación y control de la operación del flagelo (véase apéndice). La cantidad total de caracteres bien especificados (dispuestos de forma específica para la mínima función) que constituyen todas estas piezas de proteínas es de más de 10.000 residuos de aminoácidos (aa) codificados por alrededor de 50 genes. Esto es semejante a una redacción de alrededor de 2.000 palabras.
Algunos han argumentado que la cantidad mínima efectiva es inferior a 50 por cuanto ciertos tipos de bacterias pueden construir sistemas flagelares útiles con algo menos que las 30 piezas que generalmente aparecen en la lista. La tabla adjunta da una relación de 21 piezas de proteína compartidas por unas bacterias de tipo muy diferente, incluyendo Aquifex aeolicus, Bacillus subtilis, Escherichia coli, y Treponema pallidum.15
Función
| Productos genéticos |
Motor
|
MotA, MotB, FliG (C-term)
|
Base
|
FliF, FliG (N-term), FliM/N
|
Maquinaria de exportación
|
FlhB, FliQ, FliR, FliP, FliI, FlhA
|
Eje de transmisión
|
FlgB, FlgC, FlgG, FliE
|
Gancho y adaptadores
|
FlgE, FlgL, FlgK, FlgD
|
Filamento
|
FliC, FliD
|
Parece que estos 21 genes están al menos cerca del mínimo imprescindible para una función flagelar útil. En combinación con los otros genes necesarios para ayudar en la construcción de la estructura flagelar, el mínimo imprescindible parece seguir estando alrededor de 35 a 40 genes específicos. Así, queda claro que el sistema de motilidad flagelar es muy complejo desde el criterio de la información. Para conseguir la función de la motilidad el flagelo exige un mínimo de varios miles de residuos de aminoácidos que actúan juntos en una disposición muy específica o «especificada» en mutua relación..
Son muchos los intentos que se han hecho para explicar la evolución paso a paso de un sistema tan evidentemente complejo. La mayoría de estas explicaciones son muy superficiales, saltando, con un gesto displicente, sobre enormes vacíos evolutivos que involucran grandes cambios de múltiples proteínas. Sin embargo, ha habido algunos intentos más meritorios. Quizá uno de los mejores intentos para tratar de explicar la evolución del flagelo es la proposición de Nicholas J. Matzke en este artículo de 2003: «Evolution in (Brownian) space: a model for the origin of the bacterial flagellum [La evolución en el espacio (Browniano): un modelo para el origen del flagelo bacteriano]».
En aquellas fechas, Matzke era estudiante graduado de geografía en la Universidad de California en Santa Bárbara, y tenía una evidente pasión por cuestiones foráneas a la geografía. En este artículo, Matzke sugiere que el punto de partida para la evolución del flagelo fue probablemente un sistema de secreción tipo III (SSTT).
Sección de un flagelo bacteriano típico. Las subestructuras se designan
con negritas, y las proteínas en tipo normal.
Véanse las tablas al final.
con negritas, y las proteínas en tipo normal.
Véanse las tablas al final.
Sistema homólogo al flagelar. Las subestructuras se designan
con negritas, y las proteínas en tipo normal.
Véanse las tablas al final.
con negritas, y las proteínas en tipo normal.
Véanse las tablas al final.
El punto de partida
Es cosa extraña que los evolucionistas propongan tan generalmente el sistema SSTT como el punto de partida más probable, siendo que se supone que el sistema SSTT habría evolucionado cientos de millones de años después de la evolución del flagelo. Sí, la realidad es que varios científicos han sugerido en artículos bastante recientes que hay buenas razones para creer que el punto de partida del SSTT fue a partir del flagelo plenamente formado, y no al revés.2-7 Se debe considerar que el flagelo bacteriano se encuentra tanto en las bacterias mesofílicas como termofílicas, Gram-positivas, Gram-negativas y espiroquetas, mientras que los sistemas SSTT están limitados a algunas bacterias Gram-negativas. No solo están los sistemas SSTT restringidos a las bacterias Gram-negativas, sino también a bacterias Gram-negativas patogénicas que atacan de forma específica a animales y a plantas ... ¡que supuestamente evolucionaron miles de millones de años después que hubiera evolucionado la motilidad flagelar! Además, cuando los genes de los SSTT se encuentran en los cromosomas de las bacterias, su contenido en GC (guanina/citosina) es generalmente inferior al contenido en GC del genoma alrededor. Dado que los genes de los SSTT se encuentran comúnmente en plásmidos de gran virulencia (que pueden pasar fácilmente entre diferentes bacterias), esta es buena evidencia de la transferencia lateral para explicar la distribución de los genes de los SSTT. Los genes flagelares, en cambio, están generalmente repartidos entre alrededor de 14 operones, no se encuentran en plásmidos, y su contenido en GC es el mismo que el del genoma a su alrededor, lo que sugiere que el código para el flagelo no se ha difundido mediante transferencia lateral.
Así que, en todo caso, más bien parece que el sistema SSTT hubiera podido evolucionar procedente del flagelo (que de hecho contiene subcomponentes correspondientes al sistema SSTT, como un cuerpo basal que secreta diversas proteínas no flagelares — incluyendo factores de virulencia), y no a la inversa.
Sistemas de secreción. Las subestructuras se designan
con negritas, y las proteínas en tipo normal.
Véanse las tablas al final.
con negritas, y las proteínas en tipo normal.
Véanse las tablas al final.
Una adicional evidencia de esto procede del hecho de que el sistema SSTT exhibe poca homología con ningún otro sistema de transporte bacteriano (al menos con los 14 principales). En cambio, se supone que la evolución va construyendo a partir de aquello que ya existe. Por cuanto el sistema SSTT es el más complejo de todos éstos, ¿por qué no evolucionó a partir de uno de estos sistemas menos complejos, manteniendo con ello algún mayor grado de homología con al menos uno de ellos? Estos datos sugieren que en la «era pre-flagelar» no existía el sistema SSTT, ni nada homólogo al mismo. Por ello, debe haber surgido del flagelo plenamente formado mediante la eliminación de piezas preexistentes, y no al revés. Como se ha mencionado, varios científicos han estado proponiendo esta idea en la literatura reciente.2-7 Por ejemplo, consideremos el siguiente artículo publicado en 2008 por Toft y Fares:
El encogimiento del genoma es un rasgo común de la mayoría de los patógenos y simbiontes intracelulares. La reducción de los tamaños del genoma se encuentra entre las vías evolutivas mejor caracterizadas de los organismos intracelulares para ahorrar y evitar mantener unos costosos procesos biológicos redundantes. Las bacterias endosimbióticas de los insectos son ejemplos de economía biológica llevados a su punto óptimo debido a que sus genomas quedan espectacularmente reducidos. Estas bacterias carecen de motilidad, y sus procesos bioquímicos están íntimamente relacionados con los de su hospedador. Debido a esta relación, muchos de los procesos en estas bacterias o bien se han perdido o bien han experimentado un enorme remodelado para adaptarse al estilo de vida simbiótico intracelular. Un ejemplo de estos cambios es la estructura flagelar esencial para la motilidad y capacidad infectiva de las bacterias. Nuestro análisis indica que los genes responsables para el montaje del flagelo se han perdido en parte o en todo en la mayoría de los simbiontes intracelulares de las Gamma-Proteobacterias. Análisis genómicos comparados indican que se han perdido diferencialmente genes flagelares en bacterias endosimbióticas de insectos. En la mayoría de los endosimbiontes sólo se han conservado las proteínas implicadas en la exportación de proteínas dentro de la ruta del montaje del flagelo (sistema de secreción tipo III y el cuerpo basal), mientras que las involucradas en la construcción del filamento y del gancho del flagelo sólo se han conservado en pocos casos, lo que indica un cambio en el propósito funcional de esta ruta. En algunos endosimbiontes, los genes que controlan el interruptor de la exportación de proteínas y la longitud del gancho han experimentado una divergencia funcional como se constata mediante un análisis de su dinámica evolutiva. Basados en nuestros resultados, sugerimos que los genes del flagelo han divergido funcionalmente para especializarse en la exportación de proteínas desde la bacteria hacia el hospedador.13
En otras palabras, el sistema SSTT es resultado de un proceso degenerativo, no de un proceso creativo de algo estructuralmente nuevo, hablando cualitativamente, que no estuviera ya para empezar.
Pero claro, es muy práctico comenzar la explicación de un sistema de gran complejidad comenzando por el medio —o esto parecería a primera vista. De las alrededor de 27 piezas proteínicas empleadas en la estructura flagelar, 10 de ellas son homólogas con las proteínas en el SSTT. Una de estas 10 es la proteína «FliI». La FliI es una ATPasa anclada a la superficie citoplasmática de la membrana interior y probablemente suministra energía para la síntesis de la maquinaria de exportación o de transporte de proteínas segregadas, que son capturadas de forma selectiva desde el citoplasma para fines de transporte. Luego hay las proteínas que componen el aparato de transporte de la membrana interior y que probablemente constituyen el canal de conducción de proteínas. Estas incluyen FlhA, FliP, FliQ, FliR, y FlhB. El homólogo flagelar del anillo MS está compuesto de FliF y el homólogo del anillo C está compuesto de FliN y FliG. La última proteína, FliH, tiene una función desconocida.
Parece que la mayor parte de estos 10 homólogos flagelares son necesarios para la función del SSTT. De modo que la suposición de un sistema intacto proto-SSTT es un buen comienzo para tratar de explicar la evolución flagelar. La realidad es que el sistema SSTT es sumamente complejo por derecho propio, y esto sólo se acumula al concepto de que el sistema SSTT no evolucionó a partir de un sistema de menor complejidad, sino que surgió de un sistema de mucha mayor complejidad (el flagelo plenamente formado) por medio de un proceso de eliminación de componentes preexistentes —no por la adición de nuevos componentes. Evidentemente, es mucho más fácil quitar componentes y mantener funciones de un nivel inferior que ya están allí que añadir nuevos componentes a funciones de bajo nivel para conseguir funciones beneficiosas de alto nivel que todavía no existen.
Añádase a esto que algunos de los homólogos entre los sistemas flagelar y SSTT no son tan homólogos. La proteína FliN en el SSTT es solo homóloga a ~80 residuos C-terminales de FliN flagelar (de 137aa). Hay muy poca semejanza con la FliG, y la FliF del SSTT carece de los dominios C- y N-terminales que están involucrados en la formación del anillo MS. Todo lo que queda de FliF es alrededor de 90 de entre más de 550 residuos de aminoácidos. Loque esto significa es que el sistema SSTT no puede girar. La evolución de la capacidad de girar involucraría la adición de una considerable cantidad de residuos específicamente secuenciados.
En resumen, es muy difícil de explicar la función del sistema SSTT mismo usando mecanismos evolutivos sin dirección ni propósito. Todavía me queda por ver un intento razonable de explicar cómo pudo haberse originado por evolución un sistema SSTT con vacíos neutros lo suficientemente pequeños para ser salvados por mutaciones al azar del tipo que sea.
Matzke y otros evolucionistas abordan estos problemas sugiriendo que algún día pudiera encontrarse algún homólogo todavía no descubierto del aparato secretor del flagelo. Matzke explica:
Si los sistemas de virulencia de tipo III derivan de flagelos, ¿cuál es la base para emitir la hipótesis de un sistema de secreción de tipo III que sea ancestro de los flagelos? La cuestión quedaría resuelta si se descubrieran homólogos no flagelares del aparato de exportación del tipo III en otras filas bacterianas, que realizasen funciones útiles en el mundo pre-eucariota. Que no se haya descubierto todavía tal cosa constituye un argumento válido en contra del presente modelo, pero al mismo tiempo sirve de predicción: el modelo quedará considerablemente fortalecido si se descubre dicho homólogo. Por el momento, es bastante fácil explicar la falta de descubrimiento de tal homólogo en base a la falta de datos.1
¿De modo que por ahora la evidencia para la evolución del primer paso en la síntesis flagelar está escondida y segura detrás de una «falta de datos»? ¿Dónde está la «detallada» explicación de la evolución flagelar en todo esto? Bien, Matzke y otros imaginan lo que hubiera podido suceder para lograr la evolución del primer sistema proto-SSTT. El origen de este sistema proto-SSTT comienza con un homólogo de FliF, un complejo de porinas de membrana. FlhB, el complejo proteínico que controla el tipo de proteínas secretadas a través del poro, se une de alguna manera a FliF. FlhA, de función desconocida, se añadió también para que junto con FlhB, se pudiera transformar un poro transportador pasivo general en un transportador de sustrato específico. No se sugiere de dónde pudieron proceder FlhB o FlhA ni qué otras funciones hubieran podido tener ni tampoco queda claro cómo sus capacidades selectivas hubieran podido ser de ayuda, especialmente en el caso de que se hubieran seleccionado unas proteínas desacertadas para su transporte.
Sistemas con componentes homólogos a componentes flagelares.
Las subestructuras se designan con negritas, y las proteínas en tipo normal.
Véanse las tablas al final.
Las subestructuras se designan con negritas, y las proteínas en tipo normal.
Véanse las tablas al final.
En todo caso, una vez se han combinado la FlhB y FlhA con la FliF, se precisa de energía para el transporte activo. Y aquí entra FliI al rescate. La propuesta es que la F1-αβ ATPasa, un heterohexámero compuesto de subunidades α (no catalíticas) y de subunidades β (catalíticas) que se encuentra en muchos tipos de bacteria, evolucionó a partir de un antecesor común de FliI (un homohexámero compuesto de subunidades catalíticas y fuente de energía para el SSTT), por cuanto FliI comparte ~30% de homología con
Naturalmente, si se concede que se pueda obtener FliI, es fácil conseguir que la fuente de energía de la FliI se conecte al poro del FliF —¿verdad? No tan fácil. La FliI no puede acoplarse directamente a FliF. Se precisa de otra proteína llamada «FliH» para conseguir que la FliI ATPasa se acople con la FliF. No está del todo claro de dónde vino la FliH ni cómo pudo haber milagrosamente evolucionado la capacidad de unirse a ambas moléculas, FliI y FliF, precisamente de la forma adecuada. Pero la cosa es aún peor. Se precisa de otro complejo proteínico, conocido como «FliJ», para que interaccione con la FliI ATPasa y FliH antes que pueda procederse a la exportación de ningunos componentes flagelares.
Así que para que el SSTT pueda conseguir la exportación activa de la proteína, se tienen que disponer tres complejos proteínicos de forma precisa (FliI, FliH, y FliJ) — y esto simplemente para la versión imaginaria. Las otras partes del aparato secretor, FliOPQR, ni son consideradas en el «detallado» modelo por etapas de Matzke de evolución flagelar, debido a la «falta de datos».
Además de lo anterior, ¿qué hay del argumento de que las semejanzas entre las proteínas de la F1F0-ATP sintetasa y del aparato exportador flagelar de tipo III respaldan el concepto de que comparten un antecesor primitivo común? Prácticamente inmediatamente, Matzke añade: «Individual-mente, las semejanzas que se citan son fácilmente atribuibles al azar, pero juntas son al menos sugestivas».1 A mi parecer, esto suena a que hay algunos vacíos bastante grandes al menos potencialmente presentes ya en la ruta que se ha pro-puesto. Al menos, estos vacíos no se consideran con ningún detalle en el modelo de Matzke ni en ningún otro modelo que yo conozca. Estas etapas, que parecen exigir cientos de diferencias genéticas bastante específicas, se pasan por alto, simplemente con un gesto displicente, para llegar a la siguiente conclusión:
El acontecimiento clave en el origen de la exportación de tipo III fue la asociación de una primitiva F1F0-ATP sintetasa con una proto-FlhA o FlhB en el interior del anillo proto-FliF, convirtiéndolo de un transportador pasivo a otro activo. Por cuanto es poco lo que se conoce de los detalles de la actividad acopladora de la ATPasa con la exportación proteínica en la exportación de Tipo III, este paso sigue siendo especulativo.1
¿Un paso especulativo? ¡Qué sorpresa! Esto era lo que se suponía que debía ser un tratamiento «detallado» de la evolución flagelar. Hasta ahora, parece que no tenemos nada más que una especulación más bien superficial.
Complejidad irreducible
Un sistema unitario compuesto de diversas piezas que interaccionan y contribuyen a la función básica, y donde la eliminación de cualquiera de las piezas hace que dicho sistema deje realmente de funcionar.16
Behe escogió el sistema de motilidad flagelar como uno de sus ejemplos de un sistema de complejidad irreducible. Sin embargo, lo que sigue es una interesante reacción al concepto de complejidad irreducible enunciado por Behe —donde se sugiere que el sistema flagelar en realidad no es en absoluto irreduciblemente complejo:
Los científicos de la corriente dominante consideran que este argumento ha sido en gran medida refutado a la luz de una investigación bastante reciente. Observan que se ha descubierto que el cuerpo basal del flagelo es similar al sistema de secreción de Tipo III (SSTT), una estructura semejante a una aguja que usan los microorganismos patogénicos como la salmonella para inyectar toxinas en células eucariotas vivas. La base de la aguja tiene muchos elementos en común con el flagelo, pero carece de la mayoría de las proteínas que hacen funcionar a un flagelo. Así, este sistema parece refutar la aseveración de que la eliminación de cualquiera de las piezas del flagelo lo convertiría en inservible. Esto ha llevado a [Kenneth] Miller a observar que «Las piezas de este sistema complejo supuestamente irreducible tienen en realidad funciones propias».17,18
Ahora bien, uno podría construir sistemas funcionales de alto nivel, sistemas que exigen más y más requisitos estructurales mínimos necesarios, con el uso de sistemas preestablecidos más pequeños ya disponibles. Sin embargo, esta potencialidad no elimina la realidad de que los sistemas de más alto nivel tienen un mayor tamaño mínimo y mayores requisitos de especificidad antes que puedan hacerse realidad —incluso en el mínimo sentido. Todos los tipos de funciones tienen sus propios requisitos mínimos. Estos requisitos mínimos no son todos iguales. Y es esta diferencia en los requisitos mínimos lo que los distingue.
La verdadera cuestión es: ¿pueden construirse sistemas irreducibles usando componentes ya presentes en el fondo genético? Y, en tal caso, ¿es igualmente probable acabar con funciones a diferentes niveles de requisitos de tamaño y de especificidad?
Mantengo que los sistemas funcionales que exigen un mínimo de sólo unas pocas docenas de residuos de aminoácidos en una orientación bastante específica pueden evolucionar en un plazo relativamente breve (sólo unas pocas generaciones para una colonia de unos cuantos miles de millones de bacterias). Sin embargo, la probabilidad de que se puedan conseguir funciones de niveles progresivamente más elevados dentro de un plazo breve de tiempo disminuye exponencialmente con cada etapa arriba de esta escala de complejidad funcional irreducible.
Esta noción está respaldada en la literatura. Hay multitud de ejemplos de evolución «en acción» cuando se trata de funciones que exigen un mínimo de sólo unas cuantas docenas de residuos o si las posiciones de los residuos no tienen que ser demasiado especificadas (resistencia a los antibióticos, especificidad mejorada del sistema inmune, capacidad infectiva de fagos, etc.). Sin embargo, cuando se trata de funciones que exigen un mínimo de unos cuantos cientos de residuos bastante especificados operando de manera conjunta y simultánea (como en enzimas de proteínas únicas como la lactasa, la nilonasa, etc.), el número de ejemplos cae espectacularmente y la cantidad de fondos genéticos bacterianos capaces de evolucionar funciones a este nivel, incluso en un medio sumamente selectivo, cae también exponencialmente.
Cuando se llega al nivel de funciones que exigen meramente 1.000 residuos bastante especificados operando conjunta y simultáneamente, simplemente no hay ejemplos de evolución «en acción» mencionados en la literatura —ninguno en absoluto. Todo lo que tenemos al llegar a este punto son historias acerca de cómo los mecanismos evolutivos de mutación al azar y de selección basada en la función tienen que haber hecho la tarea. Es decir, simplemente cuentos basados en nada más que suposiciones. No hay observaciones reales de evolución en acción más allá de este punto —ni un solo ejemplo. Tampoco hay intentos serios de calcular las probabilidades de que la evolución se dé a tales niveles en el período propuesto de unos pocos miles de millones de años durante los que se supone que ha tenido lugar la evolución de la vida sobre esta Tierra.
El trabajo que estamos considerando aquí, de Matzke, no es una excepción. Matzke ni siquiera intenta calcular las probabilidades de que la evolución cruce ninguna de sus propuestas etapas en la ruta de la evolución del flagelo. Sencillamente se apoya, como lo hacen los demás científicos de la línea convencional, en la noción de que las semejanzas de secuencia sólo podrían ser resultado de una relación evolutiva. Los cálculos estadísticos relativos a la capacidad de mutaciones aleatorias y de la selección basada en la función para realmente poder recorrer estas etapas que se proponen parecen simplemente ser innecesarios para los científicos de la línea convencional. ¿Para qué calcular las probabilidades cuando el cuento es tan bonito?
Quizá, solo quizá, haya un pequeño problema con estos cuentos. Parece haber un problema de un vacío en expansión lineal entre lo que es y lo que pudiera ser. Cada paso ascendiendo la escala de complejidad funcional resulta en una expansión lineal del vacío no benéfico entre lo que existe en un fondo genético y la(s) siguiente(s) secuencia(s) genética(s) potencialmente benéfica(s) más cercana(s) en la inmensidad del «espacio de secuencias». Cada expansión lineal en distancia de vacío, según se define por la cantidad de cambios de los residuos que se tendrían que conseguir para llegar a la nueva función, resulta en un aumento exponencial en la cantidad de andadura aleatoria/pasos selectivos aleatorios que se necesitarían —como media. Naturalmente, esto resulta en un aumento exponencial en el tiempo medio preciso para encontrar una nueva secuencia benéfica funcional a niveles crecientemente elevados de complejidad funcional mínima.
Resumen de Maztke del modelo evolutivo para el origen del flagelo, exhibiendo las seis etapas principales y los intermedios clave. Los componentes blancos tienen homólogos no flagelares identificados o razonablemente probables; los componentes grises tienen homólogos o bien sugeridos pero sin evidencia, o ningún homólogo identificado específico, aunque se pueden postular funciones ancestrales. El modelo comienza con un poro de membrana interna pasivo algo general (1a) que se convierte a un poro para sustrato más específico (1b) por unión de la proto-FlhA y/o FlhB con FliF. La interacción de una F1F0-ATP sintetasa con FlhA/B produce un transportador activo, un primitivo aparato de exportación de tipo III (1c). La adición de una secretina que se asocia con el anillo citoplasmático convierte esto a un sistema de secreción de tipo III (2). Un sustrato mutado de secreción se transforma en una adhesina secretada (o, alterna-tivamente se coopta una adhesina por transposición de la secuencia de reconocimiento de la secreción), y una mutación posterior permite que se una al lado exterior de la secretina (3a). La oligomerización de la adhesina produce un anillo pentamérico, lo que permite más adhesinas superficiales sin que se bloqueen otros sustratos de secreción (3b). La polimerización de este anillo produce un tubo, un pilus primitivo de tipo III (4a; en el diagrama, aparece una estructura axial blanca en lugar de las subunidades individuales de pilina; todas las otras proteínas axiales descienden de esta pilina ancestral común). La oligomerización de una pilina produce la cubierta, que aumenta la velocidad y la eficiencia del montaje (4b). Una pilina duplicada que pierde sus dominios exteriores pasa a ser la proteína del protovástago, que se extiende hacia abajo a través de la secretina y que fortalece la unión del pilus mediante asociación con la base (4c). Adicionales duplicaciones de las proteínas del protovástago, del filamento y de la cubierta, que ocurren antes y después del origen del flagelo (6) producen el resto de las proteínas axiales; estos repetidos eventos de subfuncionalización no se muestran aquí. El protoflagelo (5a) se produce por cooptación de los homólogos de TolQR a partir de un sistema parejo al Tol-Pal; quizá una porción de un homólogo de TolA unido a FliF para producir proto-FliG. A fin de conseguir la mejora de la rotación, la secretina pierde sus sitios de unión al filamento axial, transformándose en el protoanillo P, y el papel de poro de la membrana exterior es asumido por el anillo chaperona de lipoproteína de la secretina, que pasa a ser el protoanillo L (5b). El perfeccionamiento del anillo L y la adición del dominio de muramidasa de la cubierta de FlgJ del vástago (que elimina la necesidad de encontrar una abertura natural en la pared de la célula) resulta en 5c. Finalmente, la unión de una proto-FliN mutante (probablemente un receptor CheC) a FliG acopla el sistema de transducción de señales al protoflagelo, lo que produce un flagelo quimiotáctico (6); la fusión de proto-FliN y CheC produce FliM. Cada etapa iría evidentemente seguida de una gradual optimización coevolutiva de las interacciones de los componentes. Así, el origen del flagelo queda reducido a una serie de pasos mutacionales verosímiles.1
Para dar algo más de detalle, la siguiente etapa, si se supone la existencia de un sistema SSTT, es la adición de un filamento. Matzke y muchos otros arguyen que es fácil elaborar filamentos simples de base proteínica —y señalan a la polimerización de la hemoglobina en pacientes de anemia falciforme como resultado de una sola mutación puntual (como cambiar una sola letra en un párrafo y conseguir una nueva función). Esta forma de pensar subestima diversos requisitos muy específicos que se precisan para formar un filamento útil de cualquier clase.
Por ejemplo, las partes de un filamento aleatorio, como las que constituyen la hemoglobina falciforme, tienen una gran susceptibilidad de agregarse en amontonamientos o largas hebras enredadas antes que sean transportadas a través de cualquier clase de poro a la superficie exterior de la célula. Evidentemente , esto no sería útil. Además, incluso si tales monómeros filamentosos logran salir a la superficie exterior sin enmarañarse, será preciso que se unan de manera preferencial en el lugar idóneo. Esto exige unas características de afinidad bastante específicas. ¿Cuál es la probabilidad de que un monómero filamentoso aleatorio de esta clase posea tales características de afinidad? Esta (im)probabilidad se traduce en una enorme cantidad de tiempo medio.
Luego hay una enorme cantidad de otros problemas potenciales para los monómeros filamentosos típicos. ¿Qué de su degradación? ¿Qué del transporte al canal y de la selectividad de la admisión en el canal? ¿Qué del atasco en el interior del canal y del taponamiento del camino? ¿Qué si el filamento acaba formando un núcleo macizo en lugar de un núcleo hueco? ¿Cómo se lograría hacer pasar más piezas filamentosas para añadirlas al extremo distal? ¿Qué sucedería si el extremo no quedase cubierto con una clase diferente de proteína que colocase cada pieza nueva de proteína filamentosa en el lugar apropiado? ¿Cuál es la probabilidad de que cualquier filamento adosado a la maquinaria de exportación vaya a ser «beneficioso» en un medio ambiente determinado —incluso como un «simple» filamento de anclaje?
Ahora bien, no es solo que las partes más y más «especiales» del filamento tienen que unirse a sí mismas y de forma correcta, así como al aparato secretor, sino que tienen que formar un filamento cuyo extremo distal pueda unirse a alguna cosa distinta que a sí mismo y a la propia superficie de la bacteria hospedadora. Por encima de todo lo demás, esto parece que es algo difícil de conseguir. ¿Cuál es la probabilidad de que un gen capaz de codificar unas proteínas filamentosas tan especializadas llegue a aparecer porque sí para que sean secretadas de una manera específica por un poro de transporte activo existente?
El «Simple» Pilus P
A fin de poder siquiera comenzar a responder a esta pregunta, consideremos qué se necesita para elaborar el más simple «filamento» bacteriano útil — como el pilus P.
El pilus P funciona como un anclaje de unión entre células bacterianas y otras. Es un delgado filamento hueco ahusado cerca del extremo. Sobre este extremo hay una proteína que se une de forma específica a ciertas clases de moléculas de azúcar en ciertos tipos de células (como células renales). Aunque este pilus es tan simple como se pueda obtener en la vida real e incluso aunque su función parece más bien humilde, está codificado por alrededor de 10 ó 11 genes — tantos como codifican el sistema secretor de tipo III (SSTT) tan evidentemente complejo. La sección proximal más gruesa está formada por componentes proteínicos PapA, y la sección distal más delgada por componentes PapE, y el extremo mismo por PapG (la «adhesina» específica que se une a los azúcares). Hay también una proteína adaptadora, PapF, que une la PapG a la PapE, y otra, PapK, que une la PapE a la PapA.14 Tenemos un total de 5 proteínas diferentes que entran en un orden muy específico. ¿Cómo se consigue este orden?
Este orden se consigue con una interacción bastante complicada de proteínas «chaperonas» o guías. Pero, en primer lugar, la célula tiene que hacer una ruta de exportación multiproteínica llamada ruta sec, que descarga material citoplasmático en el espacio periplasmático. El truco para que las bacterias Gram-negativas «deseen» desarrollar unpilus es hacer penetrar un filamento en la membrana exterior. Esto exige una sofisticada coordinación. En primer lugar, todas las subunidades del pilus se exportan preferentemente, en estado no desplegado, al interior del periplasma a través de la ruta sec donde vuelven a plegarse. Sin embargo, si se dejasen a sí mismas, formarían acumulaciones desorganizadas. De modo que se precisa de una proteína chaperona, la PapD, para impedir este problema de amontonamiento y para ayudar a una conformación apropiada del plegado con el uso de complementación de hebra donante (DSC). Las partes del filamento, por sí mismas, son sumamente inestables y nunca se pliegan de manera apropiada. Y la PapD no tiene ninguna otra función conocida.
A continuación, el complejo subunidad del pilus-chaperona interacciona de manera específica con un canal proteínico en la membrana exterior conocido como PapC. Este canal es suficientemente grande para que pase a través suyo el extremo del filamento, pero no la parte proximal. La PapD, la chaperona, entrega la unidad del pilus a la PapC, que luego ayuda en su unión al filamento en crecimiento donde cada subunidad contribuye una hebra para completar de manera perfecta el pliegue de su vecino, y así estabilizarlo.14,15
Así, incluso algo tan relativamente «simple» como la construcción de un pilus parece bastante complicado en comparación con el propuesto paso de la evolución del filamento. Sencillamente, es muy difícil elaborar un filamento «útil» —o así lo parece. Pero digamos que de alguna manera hemos conseguido que evolucione un filamento así. ¿Cómo va luego a evolucionar para llegar a ser un flagelo? Un flagelo necesita secretar proteínas para su construcción. El problema es que no hay ningún pilus P que se sepa que secrete proteínas —quizá debido al pequeño tamaño del canal o a la ausencia de una fuente asociada de energía para bombear las proteínas. En todo caso, todos estos pili son muy diferentes de los flagelos en un aspecto muy importante.
Estos pili se construyen desde el fondo, donde cada nuevo monómero añadido empuja el pilus existente hacia arriba y afuera. Los flagelos, en cambio, son construidos desde el extremo hacia afuera, donde cada nuevo monómero es añadido al extremo de modo que el extremo crece hacia afuera sobre el flagelo existente.
Imagen con electrón microscópico del extremo distal del filamento flagelar
Imagen que aparece en el Proyecto de Nanomáquinas Protónicas del gobierno del Japón: http://www.fbs.osaka-u.ac.jp/labs/namba/npn/movies/FH2gifani.gif
Imagen que aparece en el Proyecto de Nanomáquinas Protónicas del gobierno del Japón: http://www.fbs.osaka-u.ac.jp/labs/namba/npn/movies/FH2gifani.gif
El desaparecido Robert Macnab, que fue profesor de biofísica y bioquímica molecular en la Universidad de Yale y que también estudió los flagelos, observó que el mecanismo de construcción flagelar es «un proceso mucho más sofisticado que lo que ninguno de nosotros hubiéramos podido imaginar».8 Luego añadió: «Nos parece que no sería posible que el sistema funcionase con una complejidad significativamente menor».9
El filamento flagelar
Hay un tipo interesante de bacteria sin motilidad, conocida como Shigella, que posee genes flagelares, pero que no produce flagelos. Algunas estirpes de Shigella tienen más genes ausentes que otras, pero en ciertas estirpes el único gen ausente es el gen de FliD. Este gen de FliD codifica la vital proteína de la cubierta del filamento. Sin la proteína de
Detalle de la cubierta de la flagelina -
Imagen que aparece en el Proyecto de Nanomáquinas Protónicas del gobierno del Japón:
http://www.fbs.osaka-u.ac.jp/labs/namba/npn/movies/CapZoomUp.gif
Imagen que aparece en el Proyecto de Nanomáquinas Protónicas del gobierno del Japón:
http://www.fbs.osaka-u.ac.jp/labs/namba/npn/movies/CapZoomUp.gif
La cubierta FliD
Funcionamiento de la cubierta al ir alargándose el filamento
Imagen que aparece en el Proyecto de Nanomáquinas Protónicas del gobierno del Japón:
http://www.npn.jst.go.jp/movies/CapWorking.gif
Imagen que aparece en el Proyecto de Nanomáquinas Protónicas del gobierno del Japón:
http://www.npn.jst.go.jp/movies/CapWorking.gif
La cubierta tiene 5 patas, pero el extremo del filamento tiene 5,5 subunidades de flagelina en su circunferencia. De modo que siempre hay una pequeña rendija en un punto entre la cubierta y el filamento. Es en este lugar que se añade la siguiente subunidad en el filamento en crecimiento. Al añadirse la siguiente subunidad en el espacio abierto, se imprime un giro a la cubierta de modo que se abre un nuevo espacio adyacente al que se acaba de llenar. Así, mientras la cubierta gira y gira, a 10 rotaciones por segundo, se van añadiendo nuevos monómeros de flagelina (FliC) uno por uno, 50 por segundo.8
Lo que es más interesante en todo esto es que los extremos de las subunidades de la flagelina se despliegan mientras se desplazan por el tubo del hueco del filamento. Una de las razones de ello es que la flagelina plegada presenta un gran doblez en medio que la hace demasiado grande para viajar a través del tubo. Por sí mismas, las subunidades de flagelina no pueden plegarse apropiadamente. Así, la cubierta FliD tiene como misión a la vez plegar y colocar los monómeros de la flagelina. Además , el área hueca justo por debajo de la cubierta tiene alrededor del doble de tamaño que el resto del tubo y tiene el tamaño justo suficiente para permitir el plegado de una subunidad monomérica. El giro de la cubierta, en combinación con las interacciones favorables interproteínicas proporcionan la energía para este proceso de plegamiento, por cuanto no hay ATP involucrada.8
En resumen, sin esta cubierta sumamente especializada, las unidades de flagelina no pueden autoestructurarse en absoluto para constituir un filamento tan ordenado. Y ni la proteína de la cubierta ni los monómeros de la flagelina tienen ninguna otra función celular. Más allá de esto, ¿cómo sucede que se coloca la cubierta en la posición correcta en el extremo del filamento y que no se envían más monómeros de la cubierta por el tubo una vez ha quedado constituido? Una vez más, se precisa de una chaperona específica para la construcción de la cubierta y para la prevención de incorporaciones inoportunas.
Para contrarrestar este argumento, se dice que por cuanto las unidades tubulares proteínicas flagelares FliL y FliK no precisan de cubierta alguna para su correcta construcción, que la adición de una cubierta fue una modificación evolutiva tardía para mejorar la velocidad y la eficiencia.1 Un problema potencial es que la FliL y la FliK son solamente proteínas de unión. Unen el componente gancho del flagelo (FlgE) al resto del flagelo (FliC). No forman los flagelos por sí mismas. Incluso en el caso de que lo hicieran, esto, en particular, no explicaría cómo se hubieran podido autoconstruir las unidades de flagelina (FliC) sin una cubierta, ni como hubieran podido surgir por evolución sin la coevolución de la muy específica cubierta FliD — lo cual involucra una cantidad muy grande de cambios de residuos de elevada especificación para una mínima ventaja selectiva.
¿Y qué de la hipótesis de que la cubierta se formó primero, en la que la cubierta hubiera evolucionado debido a sus propiedades adhesivas, y que fue mejorada por la adicional evolución de las proteínas de pilus que extienden la cubierta hacia fuera de la célula? De nuevo, ¿cuánto tiempo sería necesario para la obtención de un monómero proteínico flagelar lo suficientemente específico para interaccionar con tal cubierta de una forma tan compleja?
Las explicaciones de Matzke no descienden a mayor detalle que esto. Si estos pasos evolutivos fuesen tan fáciles de salvar, sería fácil ensayarlos en el laboratorio. Simplemente, se debe proceder a eliminar el gen de la flagelina FliC en una bacteria, y observar si sus descendientes vuelven a formar evolutivamente el flagelo debajo de la cubierta preexistente. Que yo sepa, ningún experimento de este tipo ha tenido éxito. Como ya se ha mencionado, lo mismo sucede con las bacterias que carecen del gen de la cubierta FliD , como la Shigella. Estas bacterias pueden poseer todos los otros genes flagelares, pero han perdido el gen de la cubierta — y no pueden construir un flagelo ni han recuperado por evolución el gen de la cubierta. ¿Por qué no?
La motorización del flagelo
Bien, digamos que de alguna manera alguna colonia primitiva de bacterias pudo realmente evolucionar un sistema proto-SSTT y un sistema proto-flagelar/filamental donde cada sistema era funcional de forma independiente de alguna manera beneficiosa. En este punto, Matzke argumenta que sería algo muy simple unir estos dos sistemas para conseguir la motilidad flagelar.
Al considerar esta propuesta, volvamos un poco atrás. Recordemos que el motor flagelar se distribuye en dos unidades básicas: el estator y el rotor. El estator está compuesto de unas subunidades motA y motB (cada una de ellas formada por aproximadamente 300 residuos). El rotor está compuesto de FliM (~330aa), FliN (~130aa), y FliG (~330aa). Los tres componentes del motor están involucrados en la construcción del flagelo. El anillo C formado por estos componentes actúa como una especie de taza de medición que determina el tamaño del filamento en forma de gancho. Lo que sucede es que se unen aproximadamente 120 monómeros de gancho a la FliM, la FliN y la FliG, (4 lugares de unión cada uno). Cuando quedan llenos todos los lugares de unión, todos los monómeros quedan liberados en el acto y se forma un segmento de «gancho» de una longitud específica. Después que los monómeros del gancho salen del anillo C, entra otra proteína y convierte el anillo C de un secretor de monómeros de gancho a un secretor de monómeros de flagelina. Hay un cambio en la especificidad del anillo C respecto a los monómeros que acepta.
De modo que la FliG es importante para el montaje flagelar en cuanto parece que se precisa de los 200 residuos N-terminales de la FliG. De hecho, si se distribuyen los 331aa de la FliG en segmentos de 10aa cada uno, las mutaciones de deleción de los segmentos 11, 13, 16, 17, 20, 21, y 27 dan como resultado una falta de formación adecuada de flagelo y evidentemente de la función de motilidad. Asimismo, las bacterias con mutaciones de 1, 3, 12, 14, 15, 22, 23, y 26 de la FliG son completamente «no flageladas».10
Esto significa que la pretensión de Matzke de que la FliG, como parte del complejo protosecretor, «se retiene solo para estabilizar/apoyar el complejo secretor coadaptado y el anillo FliF, y [es] por otra parte vestigial» carece totalmente de sentido. La proteína FliG es vital para la secreción y no tiene nada que ver con la estabilización de la FliF (se ha constatado que la FliF es bien estable de forma independiente). Se trata sencillamente de que la FliF no puede formar un flagelo adecuado sin la FliG .
Naturalmente, la proteína FliG (que de pasada no tiene homólogos significativos) es también el subcomponente responsable de la conversión de la fuerza motriz protónica en fuerzas de par para el movimiento de rotación del flagelo. Los ~100 residuos C-terminales parecen ser necesarios para la ejecución de esta función. Además, unas mutaciones específicas en los segmentos 10, 18, 19, 24, 25, 28, 29 y 31 construyeron flagelos, pero quedaron paralizados.10
Por lo que se refiere a la función de rotación, la FliM y la FliN son responsables de conmutar el movimiento en uno y otro sentido —no de la creación efectiva de los pares de fuerza. Sin embargo, la FliM y la FliN siguen siendo necesarias para la construcción del flagelo.
Consideremos ahora brevemente la FliF (complejo de poros de la membrana del anillo MS central con ~550aa). La FliF no tiene homólogos conocidos fuera de los sistemas SSTT (que se consideran evolucionados a partir del sistema flagelar — no al revés). Incluso dada su existencia protoformal, tratar de elaborar una explicación de cómo un flagelo o filamento pudo haberse adherido al mismo de una manera beneficiosa por azar constituye un verdadero reto. La construcción de los filamentos incluso más simples es bastante complicada, como se ha descrito más arriba. Hay diversas proteínas chaperonas involucradas en el acarreo de monómeros específicos a su emplazamiento justo en el momento preciso y en el plegado y en la unión entre sí de forma específica. La construcción de un pilusaparentemente simple es, en realidad, extremadamente compleja. La construcción de un flagelo hueco en su emplazamiento mediante la adición de monómeros en el extremo distal es extraordinariamente complicada.
Dados estos pocos hechos presentados hasta ahora, tengo solo unas pocas preguntas. Matzke sugiere que FliG no tuvo que evolucionar con la FliF como parte del aparato exportador. ¿Cómo se puede explicar esto si la FliG es actualmente necesaria para la construcción del flagelo? Si la FliG no evolucionó con la FliF, ¿no sería entonces necesario no solo que se uniera enérgicamente a la FliF de una manera que superase las fuerzas de cizalladura de la FliG giratoria, sino también de una manera que ayudase en la construcción del flagelo? De modo que no solo la FliG tiene que unirse con la FliF, sino que además ha de presentar especificidad en su lugar para un cierto tipo de monómero filamentoso. Esto es, sin la especificidad para la flagelina de la FliG, no se forma el flagelo. Cuando el flagelo comienza a formarse en la vida real, el anillo MS (FliF) y el anillo C (FliG N-terminal + FliN + FliM) se tienen que formar primero, o no se formará el flagelo. Esto parece ineludible.
Quizá se dirá que sería más fácil si la FliG estuviera ya unida a la FliF —si originalmente la FliG hubiera evolucionado con la FliF. En tal caso ya existiría especificidad para el monómero filamentoso en su lugar y el filamento flagelar ya podría estar en su lugar, ¿verdad? Pero, en tal caso, ¿cómo podrían motA/B unirse a la FliG de una manera beneficiosa? Hay una buena cantidad de residuos muy específicos que tienen que alinearse justo en el orden correcto para que la fuerza motriz protónica de motA/B se transfiera a fuerza de par de la FliG — y esto es además de la simple unión preferencial de motA/B con FliG + FliF, ¿verdad?
De modo que, se mire como se mire, se precisa de algo más que una mera unión FliF-FliG. ¿De qué serviría la especificidad de la FliG por la flagelina si no estuviera unida primero a la FliF? ¿Y de qué serviría la especificidad de la FliG por la fuerza motriz protónica de MotA/B si no estuviera primero unida a MotA/B? Esta especificidad involucraría, con una certidumbre prácticamente total, unas pocas diferencias de posición de residuos adicionales a partir de las «proto-formas» originales. Y lo más probable es que estas diferencias precisas no fuesen secuencialmente beneficiosas de una forma que la selección natural pudiese impulsarlas adelante.
Más allá de todo esto, no va a darse un grado de unión susceptible de selección entre la FliG y la FliF con solo una o dos posiciones de residuos correctos en su sitio de entre las 46 posiciones de residuos bastante específicos que se emplean para unir la FliG con la FliF en los flagelos modernos. Para vencer los efectos de sacudida del movimiento browniano, el flagelo tiene que girar muy rápidamente (~100–300 rotaciones por segundo durante 3-4 segundos). Esto significa que se tienen que vencer un montón de fuerzas de inercia y de cizalladura para mantener la FliG conectada con la FliF. Tendría que haber una cantidad significativa de los 46 residuos de unión, que funcionan a manera de enganches, todos a la vez, a fin de vencer estas fuerzas de cizalladura en cualquier grado susceptible de selección. De hecho, los experimentos de deleción sugieren que solo el segmento 4 N-terminal de la FliG puede soportar algún cambio significativo sin una completa pérdida de la motilidad. Las mutaciones en los primeros tres segmentos N-terminales (~30aa) resultaron en una pérdida total de la motilidad —evidentemente debida a una falta de suficiente fuerza de unión con la FliF y/o una falta de capacidad para coadyuvar en la formación del flagelo.10
Sin embargo, resulta que los genes para la FliF y la FliG están situados exactamente contiguos en el genoma. Ciertas mutaciones de deleción entre la FliG y la FliF resultan en una proteína de fusión, una proteína FliG/FliF unida por un enlace covalente que de hecho funciona bastante bien. Está claro que un enlace covalente es mucho más fuerte que un enlace no covalente, de modo que se elimina la necesidad de docenas de enlaces no covalentes. Aunque la proteína de fusión por enlace covalente no funciona tan bien como el sistema silvestre sin enlace covalente, funciona lo suficientemente bien para conseguir realizar el trabajo.
Debido a esta capacidad de enlazar la FliG con la FliF mediante una unión covalente, sin necesidad de conseguir docenas de secuencias correctas, algunos me han dicho que esto hace fácil conseguir que los dos sistemas de nivel inferior beneficiosos de manera independiente (esto es, el motor y el rotor) se unan entre sí para dar origen al sistema de nivel muy superior de motilidad flagelar. Esto, sencillamente, no es cierto, debido a la necesidad multifuncional de la FliG en ambos sistemas a la vez —como se ha descrito más arriba. En pocas palabras, se mire como se mire se necesita más que un simple enlace FliF-FliG. ¿De qué serviría la especificidad de la FliG para la flagelina si no estuviese enlazada primero con la FliF? ¿Y qué de qué serviría la especificidad de la FliG para la fuerza motriz protónica de motA/B si no estuviera primero unida a motA/B? Esta especificidad involucraría bien de seguro bastantes diferencias adicionales de posiciones de los residuos comenzando con las originales «proto-formas». Y, con toda probabilidad, estas diferencias necesarias no serían secuencialmente beneficiosas de una manera en que la selección natural las pudiera impulsar hacia adelante.
Los experimentos realizados con mutaciones de FliF muestran que un «corto segmento de C-terminal» de 9 residuos aminoácidos «fundamentales» es imprescindible para la «construcción del flagelo». Obsérvese que este proceso de construcción tiene lugar en un momento en el que el motor está parado y en que no hay rotación de FliG. Los autores siguen diciendo que «la eliminación o sustitución de hasta 10 aminoácidos inmediatamente encima de la región fundamental resultaron en un flagelo paralizado».11 Esto parece bastante especificado. Los autores afirmaron que la eliminación o sustitución de 10 residuos adicionales resultaron en la parálisis del flagelo. Así, parece que la rotaciónflagelar exige algo estructuralmente específico además de lo que exija la formación del flagelo. Tiene que haber en su sitio alrededor de 19 residuos de aminoácidos de la proteína FliF con un buen grado de especificidad para que se dé tanto la construcción como la motilidad del flagelo.
Billones de billones de años
Un vacío no beneficioso de solo un par de docenas de residuos específicos necesarios en una posición específica del genoma puede no parecer mucho a primera vista, pero este vacío necesitaría billones de billones de años de tiempo medio para que una población de todas las bacterias en la tierra (~1030 individuos) pudiera salvarlo (véase el cálculo en el apéndice más adelante). De hecho, ni uno solo de los pasos evolutivos propuestos por Matzke u otros se ha demostrado como factible en ningún experimento de laboratorio. Ni tan solo uno. Sin la capacidad de poner a prueba estas historias en el laboratorio, son simplemente cuestiones no susceptibles de falsación y por ello, por definición, no tienen apoyo en el método científico. Puede que a muchos les parezca extraño siquiera considerar esto, pero esta clase de pretensiones acerca de la evolución de funciones complejas, del orden de complejidad que encontramos en el sistema flagelar, no son ciencia en absoluto —no son ni siquiera teorías. Como mucho son proposiciones no ensayadas y quizá imposibles de someter a ensayo. Dicho claramente, estos «cuentos» sobre evolución flagelar son sencillamente esto —cuentos de hadas. Y cuando se examinan con cierto detalle, no parecen convincentes ni siquiera sobre el papel.
Sencillamente, todo esto parece algo más complicado de lo que Matzke y otros científicos evolucionistas parecen querer enseñar. Consideremos esta interesantísima conclusión de Lynn Margulis, también señalada en una interesante reseña por William Dembski del trabajo de Matzke:
Lo mismo que un tentempié de bollería dulce que entretiene el hambre por un momento pero que nos priva de alimentos más nutritivos, el neodarwinismo satisface la curiosidad intelectual con abstracciones vacías de verdaderos detalles — metabólicos, bioquímicos, ecológicos o relativos a la historia natural» (Acquiring Genomes, p. 103).13
______________________________________________________________________
Referencias
1. Nicholas Matzke, Evolution in (Brownian) space: a model for the origin of the bacterial flagellum, talkreason.org, 2003 (url: http://www.talkreason.org/articles/flagellum.cfm)
2. Anand Sukhan, Tomoko Kubori, James Wilson, y Jorge E. Galán. 2001. Genetic Analysis of Assembly of the Salmonella enterica Serovar Typhimurium Type III Secretion-Associated Needle Complex. J. Bacteriology 183: 1159-1167.
3. Macnab, R. M., 1999. The bacterial flagellum: reversible rotary propeller and type III export apparatus. J Bacteriology. 181 (23), 7149-7153.
4. He, S. Y., 1998. Type III protein secretion in plant and animal pathogenic bacteria. Annual Reviews in Phytopathology. 36, 363-392.
5. Kim, J. F., 2001. Revisiting the chlamydial type III protein secretion system: clues to the origin of type III protein secretion. Trends Genet. 17 (2), 65-69.
6. Plano, G. V., Day, J. B. y Ferracci, F., 2001. Type III export: new uses for an old pathway. Mol Microbiol. 40 (2), 284-293.
7. Nguyen, L., Paulsen, I. T., Tchieu, J., Hueck, C. J. y Saier, M. H., Jr., 2000. Phylogenetic analyses of the constituents of Type III protein secretion systems. J Mol Microbiol Biotechnol. 2 (2), 125-144.
8. Macnab, R. M., Science 290, p. 2087
9. Macnab R. M., Bacteria create natural nanomachines, USA Today, 2005 (ENLACE) .
10. May Kihara, Gabriele U.
11. Bjorn Grunenfelder, Stefanie Gehrig, y Urs Jenal, Role of the Cytoplasmic C Terminus of the FliF Motor Protein in Flagellar Assembly and Rotation, Journal of Bacteriology, Mar. 2003, p. 1624–1633 Vol. 185, No. 5 (ENLACE).
12. Todas las animaciones que se presentan aquí son el asombroso trabajo de Keiichi Namba et al. del ERATO Protonic NanoMachine Project [Proyecto de Nanomaquinaria Protónica] (ENLACE).
13. William Dembski, Biology in the Subjunctive Mood: A Response to Nicholas Matzke, personal website, 2003. (ENLACE).
14. Yvonne M. Lee, Patricia A. DiGiuseppe, Thomas J. Silhavy, y Scott J. Hultgren, P Pilus Assembly Motif Necessary for Activation of the CpxRA Pathway by PapE in Escherichia coli, Journal of Bacteriology, July 2004, p. 4326-4337, Vol. 186, No. 13 (ENLACE).
15. Gracias en especial a Mike Gene por la excelente información proporcionada sobre el tema de la evolución flagelar en su web (ENLACE DESACTIVADO).
16. Behe, Michael (1996). Darwin New York
17. Wikipedia, Irreducible Complexity, último acceso 1/4/2009 (ENLACE).
18. Miller, Kenneth R. The Flagellum Unspun: The Collapse of «Irreducible Complexity» (ENLACE), con la respuesta aquí (ENLACE). (Último acceso 1/04/09.)
Proteína
|
Posición
|
Ruta secretora
|
Clase de operón
|
Tamaño
(a a) |
Estequiometría
(aprox.)
|
Función
|
Componentes integrales de la membrana
| ||||||
FliF
|
Membrana interna
|
sec
|
2
|
552
|
26
|
Rotor/Alojamiento
|
FlhA
|
Centro del anillo de FliF
|
sec?
|
2
|
692
|
2?
|
Exportación de proteína
|
FlhB
|
Centro del anillo de FliF
|
sec?
|
2
|
382
|
2?
|
Control de longitud del gancho
|
FliO
|
Centro del anillo de FliF
|
sec?
|
2
|
121
|
1?
|
Exportación de proteína Tipo III
|
FliP
|
Centro del anillo de FliF
|
sec?
|
2
|
245
|
(1?)
|
Exportación de proteína Tipo III
|
FliQ
|
Centro del anillo de FliF
|
sec?
|
2
|
89
|
(12?)
|
Exportación de proteína Tipo III
|
FliR
|
Centro del anillo de FliF
|
sec?
|
2
|
261
|
1?
|
Exportación de proteína Tipo III
|
Componentes asociados a la membrana
| ||||||
FliI
|
Lado citoplasmático de la membrana
|
---
|
2
|
457
|
(6?)
|
Exportación de proteína Tipo III
|
FliH
|
Lado citoplasmático de la membrana
|
---
|
2
|
235
|
(2?)
|
Exportación de proteína Tipo III
|
FliJ
|
Lado citoplasmático de la membrana
|
---
|
2
|
147
|
(1?)
|
Exportación de proteína Tipo III
|
Complejo rotor/conmutador
| ||||||
FliM
|
Lado citoplasmático de la membrana
|
automontaje
|
Rotor/conmutador
| |||
FliN
|
Lado citoplasmático de la membrana
|
automontaje
|
Rotor/conmutador
| |||
FliG
|
Lado citoplasmático de la membrana
|
automontaje
|
Rotor/conmutador
| |||
Anillos
| ||||||
FlgI
|
Pared celular de peptidoglicano
|
sec
|
2
|
365
|
26
|
Casquillo-cojinete
|
FlgH
|
Membrana externa
|
sec
|
2
|
232
|
26?
|
Casquillo
|
FlgA*
|
Espacio periplasmático
|
sec
|
2
|
219
|
?
|
Montaje del anillo P
|
Proteínas axiales
| ||||||
FliE
|
Espacio periplasmático
|
Tipo III
|
2
|
104
|
9?
|
Vástago de transmisión
|
FlgJ*
|
Espacio periplasmático
|
Tipo III
|
2
|
313
|
5?
|
Cubierta del vástago (?)
|
FlgB
|
Pared celular de peptidoglicano (P)
|
Tipo III
|
2
|
138
|
6?
|
Vástago de transmisión
|
FlgC
|
Pared celular de peptidoglicano (P)
|
Tipo III
|
2
|
134
|
6
|
Vástago de transmisión
|
FlgF
|
Pared celular de peptidoglicano (P)
|
Tipo III
|
2
|
251
|
6
|
Vástago de transmisión
|
FlgG
|
Extracelular
|
Tipo III
|
2
|
260
|
26
|
Vástago de transmisión
|
FlgE
|
Extracelular
|
Tipo III
|
2
|
402
|
~130
|
Junta universal
|
FlgD*
|
Extracelular
|
Tipo III
|
2
|
231
|
5?
|
Cubierta del gancho
|
FlgK
|
Extracelular
|
Tipo III
|
3a
|
547
|
11
|
Elemento de unión
|
FlgL
|
Extracelular
|
Tipo III
|
3a
|
317
|
11
|
Elemento de unión
|
FliC
|
Extracelular
|
Tipo III
|
3b
|
498
|
~20000
|
Filamento
|
FliD
|
Extracelular
|
Tipo III
|
3a
|
468
|
5
|
Cubierta del filamento
|
Proteínas motoras
| ||||||
MotA
|
Membrana interior/citoplasma
|
sec
|
3b
|
295
|
32?
|
Motor/Estator
|
MotB
|
Pared interior/ peptidoglicano
|
sec
|
3b
|
308
|
16?
|
Estator
|
Proteína
|
Posición
|
clase de operón
|
Estequiometría
(aprox.)
|
Función
|
Citoplasmática
| ||||
FlhC
|
Citoplasma
|
1
|
--
|
Regulador maestro para operones de clase 2
|
FlhD
|
Citoplasma
|
1
|
--
|
Regulador maestro para operones de clase 2
|
FlhE
|
Citoplasma
|
2
|
--
|
?
|
FliK
|
Citoplasma, se une con FlhB
|
2
|
--
|
Control de la longitud del gancho
|
FliL
|
Citoplasma
|
2
|
--
|
?
|
FliA
|
Citoplasma
|
2
|
--
|
Factor sigma para operones de clase 3
|
FlgM
|
Citoplasma
|
3a
|
--
|
Factor anti-sigma
|
FlgN
|
Citoplasma
|
3a
|
--
|
Chaperona específica de FlgK y FlgL
|
FliS
|
Citoplasma
|
3a
|
--
|
Chaperona específica de FliC
|
FliT
|
Citoplasma
|
3a
|
--
|
Chaperona específica de FliD
|
Quimiotaxia
| ||||
Proteínas quimiotácticas aceptoras de metilos (MCPs)
|
(# copias/célula)
| |||
aer
|
Membrana interna
|
--
|
150
|
Receptor de oxígeno
|
tap
|
Membrana interna
|
--
|
150
|
Receptor de dipéptidos
|
tar
|
Membrana interna
|
--
|
900
|
Receptor de aminoácidos
|
tsr
|
Membrana interna
|
--
|
1600
|
Receptor de aminoácidos
|
trg
|
Membrana interna
|
--
|
150
|
Receptor de proteínas enlazantes con azúcares
|
Transducción de señales
| ||||
CheW
|
Lado interior de IM (unido a MCP)
|
--
|
3000
|
Une MCP a CheA
|
CheA
|
Lado interior de IM (unido a MCP)
|
--
|
3000
|
Histidin-proteín-kinasa (HPK)
|
CheY
|
Citoplasma
|
--
|
3000–17500
|
Regulador de respuesta
|
Regulación de respuesta
| ||||
CheZ
|
Citoplasma
|
--
|
1200
|
Regulador de respuesta; fostafasa
|
CheB
|
Citoplasma
|
--
|
1700
|
Regulador de respuesta; metilestearasa
|
CheR
|
Citoplasma
|
--
|
850
|
Metiltransferasa
|
Cálculo de «billones de billones de años»
(Enlace)
Tamaño de población
Tamaño de población
Tomemos una población de bacterias del tamaño de todas las bacterias que existen actualmente en toda la Tierra —alrededor de 1e30 bacterias. Digamos que esta población en estado estacionario produce una nueva generación a un ritmo de 20 minutos y que tiene una tasa de mutaciones de 1e-8 por posición de codón —dado un genoma por bacteria de 10 millones de codones. ¿Cuánto tiempo necesitaría una población así para encontrar una nueva función beneficiosa al nivel de 1.000 residuos aminoácidos bastante especificados?
Ante todo, ¿qué son residuos aminoácidos «bastante especificados»? Se trata de una medida de la flexibilidad de la secuencia que puede ser tolerada por un sistema funcionalmente benéfico. Entre otros ejemplos tenemos enzimas como la lactasa, la nilonasa o la penicilinasa u otras clases de proteínas funcionalmente benéficas como el citocromo C (CytoC) que ayuda a producir energía como parte de la cadena de transporte de electrones en las mitocondrias. También se incluyen sistemas que exigen proteínas múltiples dispuestas de forma específica y que trabajan conjunta y simultáneamente —como los sistemas giratorios de motilidad flagelar. Cada uno de estos tipos de sistemas funcionales de base proteínica tiene un cierto grado de flexibilidad que se puede tolerar sin una pérdida completa de la función en cuestión. Sin embargo, esta flexibilidad tiene un cierto límite. Algunos sistemas funcionales son muy flexibles, mientras que otros tienen fuertes constricciones. El CytoC, en particular, está más limitado de lo normal, y por ello tiene un grado bastante alto de «especificidad» de secuencia/estructura.
Algunos autores, como Durston et. al., designan estos límites a la flexibilidad de la secuencia «complejidad funcional de secuencia», o «FSC» por sus siglas en inglés.1 Según Durston et. al., la medida de la FSC de la molécula completa es la suma total de la FSC medida para cada ubicación en las secuencias alineadas en unidades llamadas «correspondencias» [fits]. El valor máximo por situación de residuo es 4,32 correspondencias/ubicación (log2 de 20) y este valor puede materializarse sólo si puede tolerarse justo una opción de residuo de aminoácido (de entre un total posible de 20) en el sitio. El valor más bajo posible es cero, y este valor se materializa en una ubicación determinada si se pueden tolerar todas las 20 opciones de residuos en dicha ubicación (esto es, una flexibilidad total). En otras palabras, una secuencia al azar tendría un valor de correspondencia de cero. En el estudio de Durston, el promedio de los valores de correspondencia [Fit] por ubicación («Densidad de FSC»] para las proteínas enumeradas es de alrededor de 2,2 (tomado de la Tabla 1).1
Por ejemplo, si encontramos que la familia de proteínas ribosómicas S12 tiene un valor de correspondencia [Fit] de [359], podemos usar las ecuaciones que hemos expuesto hasta ahora para predecir que hay alrededor de 1049 diferentes secuencias de los 121 residuos que podrían entrar en la familia de proteínas ribosómicas S12, resultando en un objetivo de búsqueda evolutiva de aproximadamente un 10–106 por ciento del espacio de secuencias de los 121 residuos.
En otras palabras, un valor de correspondencia [Fit] de «359» significfa que sólo 1 de cada 2359 secuencias tiene la funcionalidad que se necesita. Para conseguir la proporción de secuencias con este tipo de función, multiplíquese esta fracción por el tamaño total de la secuencia de espacio de 121aa o 20121. Tenemos (1/2359) (20121) = 1049. Otra forma de decir esto es que el valor promedio por ubicación para esta proteína, o la «densidad de FSC», es de alrededor de 2,966 correspondencias [Fits] por ubicación de residuo. Esto significa que sólo hay disponibles alrededor de 2,55 opciones de residuos de entre 20 por ubicación.
Bajo esta luz, consideremos el trabajo de académicos como Yockey2-5 sobre estimaciones de proporciones de CytoC en el espacio de secuencias. La estimación de Yockey para la cantidad de secuencias con la función CytoC es de alrededor de 1e65 para un espacio de secuencias de 100aa. Esto asciende a alrededor de la densidad promedio de FSC de las secuencias dadas por Durston de alrededor de 2,2 correspondencias por ubicación. Para una secuencia de 100aa con una densidad de FSC de 2,2 la fórmula de Durston produciría (1/2220)(20100) = 1e63; esto está muy cerca de la predicción de Yockey. Los grados de flexibilidad de secuencia determinados experimentalmente de forma directa usando mutaciones en cassette por investigadores como Sauer, Olsen, Bowie, Axe y otros parecen confirmar estas estimaciones aproximadas generales para tasas de sistemas individuales.6-9
Así, ¿qué nos dicen estas proporciones acerca del espacio de secuencia/estructura? ¿Qué significan? Estas proporciones tan nimias sugieren poderosamente que sistemas bastante especificados como el CytoC y otros sistemas parecidos son relativamente raros en el espacio de secuencias. Sólo para tener una cierta idea, todo el Desierto del Sahara contiene sólo alrededor de 1e30 granos de arena. ¡Y sólo hay alrededor de 1e80 átomos en todo el universo! El espacio de secuencias de proteínas se vuelve rápidamente mucho más grande que muchos universos.
¿Y todo esto, entonces, qué significa? Bien, consideremos la probabilidad de que cualquier cosa dentro del fondo genético de 1e30 bacterias que estamos considerando (con las características señaladas más arriba) se encuentre dentro de una diferencia de residuo de un sistema determinado de base proteínica con un valor promedio de FSC de 2,2.
Una densidad de FSC de 2,2 produciría 1e63 secuencias proteínicas con un tamaño de 100aa para una relación de proteínas con la función dada en cuestión de alrededor de 1 en 1e67 (o 1e-67 de entre todo el tamaño del espacio de secuencias de alrededor de 1e130). Para un sistema de un mínimo de 1000aa con la misma densidad de FSC la cantidad total de secuencias con la función dicha sería de alrededor de 1e638 —un número muy, pero que muy grande. Sin embargo, el tamaño total del espacio de secuencia a este nivel es de alrededor de 1e1301 (es decir, 201000). Esto lleva a una proporción global de 1 en 1e663. Así, la proporción global de 1e-663 al nivel de 1000aa es un número mucho, pero que mucho más pequeño en comparación con el nivel de FSC de 1e-67 para 100aa —suponiendo el mismo grado de especificidad global. Una diferencia de casi 600 órdenes de magnitud no es realmente ni siquiera susceptible de comparación.
Así, ¿cuál es el máximo vacío posible (Distancia de Hamming) entre cualquier secuencia de partida en concreto en nuestro fondo genético y una de estas 1e638 secuencias potencialmente benéficas? Una secuencia maximalmente distante es aquella que tiene todas sus ubicaciones con un diferente residuo en comparación con la secuencia de partida (esto es, Máxima Distancia de Hamming). ¿Cuántas de estas secuencias existen en un espacio de secuencias de 1000aa? Bien, hay 191000 para un total de 1e1278. Siendo que la cantidad total de secuencias objetivo es de 1e638, es posible que todas las secuencias objetivo pudieran tener una distancia maximal de una secuencia de partida.
Ahora vamos a la cuestión verdaderamente importante: ¿Cuál es la distancia probable del vacío desde una secuencia de partida determinada hasta la secuencia objetivo más cercana en el supuesto de que no se conozcan las ubicaciones reales de las 1e638 secuencias objetivo? Es muy improbable que el punto de partida esté maximalmente distante de todos los objetivos. La probabilidad de que una sola secuencia de 1000aa esté a una distancia maximal es de 19/201000 = ~1e-23. Así, la probabilidad de que 1e638 de tales secuencias estén a una distancia maximal es de 1e-231e638 —un número de extrema improbabilidad. De modo que la probabilidad de que una secuencia de partida esté más cerca que la máxima distancia posible para 1000 diferencias para al menos un objetivo en el espacio de secuencias es esencialmente segura. Esto parece prometedor para el mecanismo evolutivo de mutaciones al azar y selección natural ... ¿o quizá no?
Bien, consideremos la probabilidad de que una secuencia de partida tenga 50 diferencias de residuo respecto de una secuencia objetivo determinada con una ubicación desconocida (es decir, que tenga al menos 950 de 1000 ubicaciones iguales que el objetivo). La probabilidad de tener al menos 950 ubicaciones idénticas de residuos se puede calcular usando la fórmula para probabilidades binomiales. La probabilidad de 950 posiciones de residuos coincidentes de entre 1000 (dejando un vacío de diferencias de 50aa) usa la siguiente fórmula para la probabilidad binomial:
P(k de N) = |
N!
k!(N-k)!
|
(pk)(1-p)N-k
|
Donde:
N = cantidad de oportunidades para que se dé el acontecimiento x;
k = cantidad de veces que ocurre el acontecimiento x o que se estipula que ha de ocurrir;
p = probabilidad de que el acontecimiento x ocurrirá en cualquier ocasión determinada; y
q = la probabilidad de que el acontecimiento x no ocurrirá en ninguna ocasión
Sustituyendo con cantidades:
P(950 de 1000) =
|
1000!
950!(1000-950)!
|
(0,05950)(1–0,05)1000-950
|
= ~1e-1153
Esta es la probabilidad de producir exactamente 950 coincidencias a partir de una secuencia de 1000aa.
Añadiendo los resultados para coincidencias para 950 hasta 1000 posiciones resulta en una ligera mejora de la probabilidad de que haya al menos una coincidencia dentro de una diferencia de 50aa (esto es, hasta alrededor de 1e-1152).
En otras palabras, se precisaría de unas 1e1152 secuencias de 1000aa para que una de ellas concordase con las 950 posiciones de residuos para conseguir un vacío de una amplitud con una diferencia de solo 50aa entre cualquier punto de partida y un objetivo determinado en el espacio de secuencia a estas proporciones —como media. Sin embargo, tenemos alrededor de 1e638 secuencias objetivo. ¿Acaso no se dará, teniendo una cantidad tan grande de secuencias objetivo potenciales, que al menos una de ellas esté dentro de una distancia de Hamming de 50? Bien, desde luego que las probabilidades mejoran, pero no de modo significativo. Tomemos la probabilidad individual de éxito para encontrar una sola secuencia objetivo, 1e-1152, y multipliquemos esta probabilidad por la cantidad de secuencias objetivo potenciales, 1e638, y el resultado sigue siendo que la probabilidad es de de 1 en 1e514 ciclos de 1e638 ensayos —esto es, sigue siendo esencialmente imposible.
Esto es prácticamente como encontrar un átomo marcado situado en una ubicación desconocida del universo, compuesto de alrededor de 1e80 átomos, al menos 6 veces seguidas ¡al primer intento cada vez! Prácticamente todo el mundo consideraría tal improbabilidad como una absoluta «imposibilidad». Esto hace que una distancia de vacío tan pequeña como una diferencia de 50aa en este caso sea también esencialmente imposible.
¡Ah, pero nuestra población está constituida por 1e30 bacterias con 1e7 codones cada una. Esto es un total de 1e37 codones potencialmente diferentes. Esto equivale a 1e34 secuencias con un tamaño de 1000aa cada una (esto es, 1e34 puntos de partida). Esto mejora la probabilidad, pero no de manera significativa. El cálculo es 1e514/ 1e34 = 1e480. Es una mejora en la probabilidad de éxito porque se necesitarían menos secuencias, en promedio, para conseguir una distancia en el vacío de una diferencia de 50aa o menos. Pero esta «mejora» difícilmente resuelve el problema. La improbabilidad sigue ascendiendo esencialmente a una imposibilidad.
La cantidad promedio o esperada de posiciones homólogas de residuos (esto es, la media) es de 50. Esto produce una distancia esperada promedio de vacío de Hamming de alrededor de 950 diferencias de residuo entre una secuencia de partida determinada de 1000aa y una secuencia objetivo. Dadas estas cifras y las probabilidades calculadas, la sugerencia de que pudiera existir una distancia de vacío de una diferencia de sólo 50aa entre cualquiera de las 1e34 secuencias de partida y cualquier secuencia benéfica «objetivo» potencial parece extraordinariamente improbable —hasta el punto de la imposibilidad práctica.
El contraargumento, naturalmente, es que esta bajísima proporción sería únicamente representativa de un solo tipo de función. En realidad, muchos sistemas potencialmente benéficos de diferentes tipos existirían a los diversos niveles de espacios de secuencias/estructuras con estos requisitos de umbral estructural mínimo. Así, la cantidad de secuencias potencialmente beneficiosas como combinación colectiva de todos los tipos debería aumentarse significativamente a cada nivel. ¿Por qué considerar sólo secuencias del CytoC o de la lactasa? ¡Podría haber billones de tipos desconocidos de secuencias potencialmente beneficiosas en el espacio de secuencias/estructuras!
Este es un argumento interesante. En tanto que es cierto que tiene que existir una cantidad bastante grande de tipos singulares de sistemas funcionales beneficiosos al nivel de 1000 residuos bastante especificados, esta cantidad en realidad no afecta a la proporción en un grado significativo por lo que se refiere al problema que tenemos planteado —incluso si se es muy generoso para imaginar la cantidad global de todos los tipos de secuencias potencialmente beneficiosas en el potencial del espacio de secuencias a diversos niveles de complejidad funcional.
En un artículo publicado en 2000, Thirumalai y Klimov hacen los siguientes y pertinentes comentarios:
Las estructuras compactas de mínima energía (MECSs por sus siglas en inglés), que exhiben propiedades semejantes a las de proteínas, exigen que los estados fundamentales tengan residuos H rodeados de una gran cantidad de residuos hidrofóbicos tal como se permite topológicamente. ... Hay implicaciones del espectacular descubrimiento de que la cantidad de MECSs, con características semejantes a las proteínas, es muy pequeño, y que no aumenta significativamente con el tamaño de la cadena polipeptídica.
La cantidad de secuencias posibles para una proteína con N aminoácidos es de 20N que, para N = 100, es de aproximadamente 10130. La cantidad de pliegues en las proteínas naturales, que son estructuras compactas de baja energía libre, es evidentemente mucho menor que la cantidad de posibles secuencias. ...
La cantidad de estructuras proteínicas es muy inferior a la cantidad de secuencias. Al imponer unos simples rasgos genéricos de las proteínas (baja energía y compactación) sobre todas las posibles secuencias observamos que el espacio de estructuras es escaso en comparación con el espacio de secuencias. Incluso si el espacio de secuencias crece exponencialmente con N (la cantidad de residuos aminoácidos [por 20N], conjeturamos que la cantidad de estructuras compactas de baja energía solo aumenta como lnN [el logaritmo natural o el poder al que se tendría que elevar e (2.718 . . . ) para llegar a N] . . . La cantidad de secuencias para el que aparece un pliegue determinado como estructura nativa se reduce adicionalmente debido al doble requisito de estabilidad y de accesibilidad cinética. ... También sugerimos que el requisito de funcionalidad puede reducir aún más la cantidad de secuencias con competencia biológica.10
De modo que si, al crecer el tamaño del espacio de secuencias por 20N, la cantidad de sistemas proteínicos siquiera teóricamente útiles sólo aumenta por el logaritmo natural de N, este diferencial produce rápidamente una discrepancia inimaginablemente enorme entre los potenciales sistemas objetivo y no objetivo. Por ejemplo, el tamaño del espacio de secuencias de 1000aa es de 201000 = ~1e1301. Según estos autores, ¿cuál es la cantidad de estructuras proteínicas potencialmente útiles contenidas dentro de este espacio? Es de 20ln1000 = ~1e9.
Esta cifra resultado del cálculo es respaldada por otras numerosas estimaciones de la extremada rareza de secuencias aminoácidas viables (es decir, estables) en el espacio de secuencias proteínicas. Según la literatura, parece haber un acuerdo general de que la cantidad probable de «pliegues» proteínicos estables es inferior a 10.000.
La cifra estimada de pliegues varía ampliamente de 700 a ~8000 en base a diferencias en supuestos y conjuntos de datos (Orengo et al. 1994; Zhang y DeLisi 1998; Govindarajan et al. 1999; Wolf et al. 2000; Coulson y Moult 2002; X. Liu et al. 2004). El hecho de que existan ya 898 pliegues proteínicos solubles, según la actual edición de la base de datos SCOP (v 1.69) (Murzin et al. 1995), indica que la cantidad excederá en mucho a 1000.14
Y, según Govindarajan S. et al.:
Nuestros resultados sugieren que hay aproximadamente 4.000 posibles pliegues, algunos tan improbables que sólo existen aproximadamente 2.000 pliegues entre las proteínas naturales.20
Ahora la cuestión ahora se convierte en: ¿Qué tamaño tienen los pliegues proteínicos viables? Bien, la inmensa mayoría de los mismos tienen un tamaño inferior a 300aa.
Los dominios de los pliegues tienen generalmente una longitud de 50–200 residuos y utilizan una secuencia específica de cadenas laterales para codificar estructuras terciarias enriquecidas en su estructura secundaria con núcleos hidrófobos que quedan protegidos del solvente por una superficie predominantemente hidrófila.15
Así, con menos de 10.000 pliegues viables de proteína de tamaño 300aa o menos, ¿cuántas secuencias viables hay por pliegue? Bien, dado un FSC de un pliegue viable de sólo 2,0, la estimación procede como sigue:
2,0 x 300aa = valor de correspondencia [fit] 600. 1 en 2600, o 1e-180 x 20300 = ~1e120 secuencias estables/viables por pliegue. Multiplicando 1e120 por 10.000 pliegues = 1e124 de secuencias estables/viables totales en todo el espacio de secuencia de 300aa. La razón de viables frente a no viables es de 1e24 / 20300 = ~1e-267.
De modo que la fórmula de 20lnN pliegues viables es en realidad una sobrestimación, en todo caso, y sobrestima la cantidad total de secuencias viables en el espacio de secuencias. ... 20ln300 = ~1e7 · 1e120 = 1e127 secuencias viables por esta fórmula. De modo que la estimación basada en 20lnN es en realidad una generosa estimación de la cantidad total de secuencias viables/estables en el espacio de secuencias —y esto incluso sin considerar secuencias a la vez estables/viables y beneficiosas para un organismo determinado en un medio particular.
Aunque muchas secuencias se pliegan en la misma o esencialmente la misma estructura 3D como una cantidad absoluta, como cantidad relativa al tamaño del espacio de secuencias, es una proporción muy diminuta. La razón de esto es porque hay «una disminución exponencial observada experimentalmente en la fracción de proteínas funcionales con cantidades crecientes de mutaciones (Bloom et al. 2005)».11
Nuestra teoría predice que para grandes cantidades de sustituciones la probabilidad de que una proteína retenga su estructura disminuirá exponencialmente con la cantidad de sustituciones, donde la severidad de esta disminución estará determinada por las propiedades de la estructura. ... Nuestro trabajo unifica observaciones relativas al apiñamiento de proteínas funcionales en el espacio de secuencias. ...» [énfasis añadido].12
Se ha demostrado mediante experimentos que las proteínas pueden ser sumamente tolerantes a sustituciones solitarias; por ejemplo, un 84% de mutantes de un solo residuo de la lisozima T4 y el 65% de los mutantes de un solo residuo del represor lac resultaron funcionales. Para sustituciones múltiples, la fracción de proteínas funcionales disminuye aproximadamente de forma exponencial con la cantidad de sustituciones, aunque la severidad de esta disminución varía entre las proteínas.12
En resumen, la mayoría de las mutaciones que afectan a una agrupación regional o insular de secuencias termodinámicamente estables en el espacio de secuencias son desestabilizadoras en tal manera que cada mutación adicional tiene un efecto desestabilizador exponencial. Evidentemente, esto significa que la inmensa mayoría de secuencias en el espacio de secuencias no producirá proteínas viables y estables. También sugiere que al aumentar el espacio de secuencias en tamaño por 20N, la proporción de secuencias viables frente a secuencias no viables, no meramente sistemas, disminuye exponencialmente.
Pero, a fin de seguir el argumento, seamos abrumadoramente generosos y digamos que la cantidad de sistemasbeneficiosos singularmente diferentes al nivel de umbral de 1000aa, desde la perspectiva de una colonia bacteriana determinada, no es justo de 20ln1000 = ~1e9 o mil millones, o incluso 10 mil millones, o un billón, sino de 100 billones (1e14) de sistemas objetivo potencialmente beneficiosos al mismo nivel de complejidad funcional. Naturalmente, dado que el grado de especificidad ya está dado para este nivel de umbral (como se ha indicado antes), cada uno de estos sistemas queda representado por 1e707 secuencias aminoácidas (donde cada sistema de base proteínica bastante especificado tiene un tamaño de 1000aa). ¿Qué haría esto respecto a la cantidad total de secuencias potencialmente beneficiosas en el espacio de secuencias? Bien, lo multiplicaría por 1e14 para dar un total de alrededor de 1e721 en lugar de 1e707 secuencias beneficiosas. Igualmente, aumentaría la proporción de beneficioso frente a no beneficioso 1e14 veces hasta 1e-580 (a partir de 1e-594).
En relación con el problema planteado, es poca la diferencia entre una proporción de 1e-580 respecto de una proporción de 1e-594. La probabilidad de tener una sola secuencia de partida dentro de diferencias de 50 residuos de cualquier secuencia objetivo potencialmente viable sigue siendo esencialmente cero a alrededor de 1e-431 (esto es, 1e-1152 x 1e721).
Por esta razón las islas de secuencias proteínicas viables/estables están tan aisladas en los espacios de secuencias y devienen exponencialmente más y más aisladas con los crecientes requisitos mínimos de tamaño y/o de especificidad.
El efecto básico del plegado de la proteína capturado por este modelo es que, al irse plegando la cadena, es obligada a tener un interior (núcleo) y un exterior (superficie) claramente definidos determinados por la doble identidad de sus residuos. La hidrofobicidad de pequeñas proteínas de dominio de plegado simple tiene su pico hacia alrededor de la mitad, de modo que aproximadamente una mitad de los residuos se fuerzan hacia el núcleo. Una menor hidrofobicidad resulta en secuencias sin plegado, mientras que una mayor hidrofobicidad lleva a la agregación ...
Los resultados de este modelo sugieren que el espacio de secuencias de las proteínas de dominio de plegado simple se reparte entre familias de baja frustración mutuamente disimilares que se pliegan en estructuras nativas mutuamente disimilares. El principio por el que surge esta situación es el requisito de diseño de frustración minimal, que permite el plegado eficiente de secuencias en sus estructuras funcionales (nativas) ...
El espacio de secuencias como poblado por familias, donde cada una de ellas se pliega en una burda estructura granulada particular y cada una de ella rodeada de una corteza de secuencias crecientemente frustradas ... Esto produce una barrera de frustración, es decir, una región de secuencias frustradas entre cada par de familias frustradas minimalmente. Cualquier ruta mutacional gradual entre una familia de secuencia frustrada minimalmente y otra tiene que visitar luego una región de secuencias lentas o carentes de plegado. ... En el caso de proteínas reales, las secuencias en estas regiones de elevada frustración tienen mucha menos propensión a cumplir requisitos fisiológicos sobre la capacidad de plegado. ... Si el requisito es suficiente, la región entre ambas familias quedará completamente excluida, lo que corta el espacio de secuencias en partes estables y separadas de pliegue rápido. Esto proporciona un mecanismo para la partición de la información de secuencia proteínica en subconjuntos evolutivamente estables y bioquímicamente útiles (plegables).16
De modo que ahora que vemos que las islas de proteínas viables / estables / «no frustradas» están desde luego separadas de forma específica, por todos lados, por secuencias no viables, y vemos que esta separación aumenta, de forma lineal (un aumento lineal en la distancia de Hamming) con cada aumento en el tamaño mínimo y/o en los requisitos de especificidad, ¿qué sucede al nivel de 1000 fsaars de complejidad funcional?
Al nivel de complejidad bastante especificado de 1000aa, ¿qué significa un vacío de una diferencia de residuos de simplemente 500aa — dados los anteriores cálculos que exponen que con casi total seguridad existirá una distancia de Hamming de al menos 50 entre una isla determinada de secuencias viables, por no hablar de beneficiosas, y la siguiente isla más cercana viable potencialmente beneficiosa en el espacio de secuencias? ¿Qué hará esta distancia de vacío al potencial evolutivo?
Pues bien, consideremos que incluso para proteínas mucho más pequeñas con tamaños de sólo 18aa y vacíos con distancias de Hamming de menos que media docena Cui et al. sugieren que estas distancias están esencialmente más allá de la posibilidad de ser salvadas mediante mutaciones génicas.
Las exploraciones evolutivas por mutaciones génicas pueden ser asemejadas a la difusión. Su alcance es limitado en un paisaje fragmentado de mortalidad, porque las secuencias que pertenecen a diferentes sistemas (Tabla 1) están fuera de su alcance.17
Dados estos generosísimos supuestos, ¿cuánto tiempo se necesitará para introducir estos 50 cambios necesarios de los caracteres en al menos una secuencia en una bacteria de nuestra enorme población de 1e30 bacterias? —una población tan grande como la de todas las bacterias en la Tierra?
Pues bien, cada una de nuestras secuencias de partida tiene que investigar un espacio de secuencias de al menos 1e65/1e34 = ~1e31 secuencias antes de alcanzar el éxito. Con una tasa de mutaciones de 1e-8 por codón por generación, cada secuencia de 1.000 codones mutará una vez cada 1e5 generaciones. Con un tiempo de generación de 20 minutos, esto significa una etapa mutacional cada 2.000.000 minutos; lo que equivale a ~ 4 años. De modo que con esta andadura aleatoria/etapa mutacional cada 4 años, se necesitarían 1e31 x 4 = 4e31 años para que al menos un individuo en toda la población tuviera éxito —como media (esto es, billones de billones de años).
Cuando he presentado este problema, algunos han sugerido que si toda la población comienza a partir de un solo punto de partida en lugar de estar esparcida en diferentes lugares en el espacio de secuencias, que entonces mejorarían las probabilidades de cruzar una distancia de Hamming de 50. Por ejemplo, una distancia de Hamming de 1 alrededor de una isla de 1000aa es igual a 19 veces 1000, o 19.000 secuencias dentro de una diferencia de un carácter. Si el tamaño de población fuese sólo 1000 secuencias idénticas de 1000aa (es decir, comenzando todos en la misma isla), se precisaría de alrededor de 100 generaciones para que mutase una de las secuencias en la población. De modo que, suponiendo que no hay mutaciones repetidas, se necesitarían 19.000 x 100 = 1.900.000 generaciones para explorar todas las secuencias inmediatamente adyacentes a la isla del punto de partida (alrededor de 72 años). Sin embargo, si la población de partida aumentase a 1 millón, alrededor de 10 de estas secuencias mutarían cada generación. Así, suponiendo la inexistencia de mutaciones repetidas, se precisaría de 19.000 / 10 = 1.900 generaciones (algo menos que un mes).
Así, es evidente que el aumento del tamaño de la población puede tener un efecto espectacular acerca de la velocidad con la que se puede investigar una distancia de Hamming determinada. La cuestión es: ¿que tamaño de una población de partida sería necesario en una isla determinada para investigar el espacio dentro de una distancia de Hamming de 50 en un lapso de tiempo razonable? ¿En digamos que 4 mil millones de años?
Veamos. La distancia de Hamming de 50 contiene 1e65 secuencias. La cantidad de 1000aa secuencias contenida por todas las bacterias de la tierra es de solamente 1e34. Así, si todas estas secuencias comenzaron en la misma isla, ¿cuánto se tardaría en cubrir una distancia de Hamming de 50? En cada generación se explorarían 1e29 secuencias. Así, 1e65/1e29 = 1e36 generaciones ... o alrededor de 1e31 años (es decir, más de 10 millones de billones de billones de años).
Esto difícilmente resuelve el problema ... especialmente si consideramos que es mucho más probable que el vacío de la distancia de Hamming vaya a ser de más que 150 en lugar de sólo 50 al nivel de 1000 fsaars.
Pero, ¿qué hay de estos argumentos, a menudo fomentados en grupos de discusión como Talk.Origins, que sugieren que el espacio de secuencias está mucho más abarrotado de objetivos potenciales que lo que se menciona aquí?
Las secuencias funcionales no son tan infrecuentes ni aisladas. Hay experimentos que demuestran que aproximadamente 1 en 1011 de todas las proteínas de secuencia aleatoria tienen actividad ATP-ligante (Keefe y Szostak 2001), y el trabajo teórico de H. P. Yockey (1992, 326-330) expone que a esta densidad todas las secuencias funcionales están conectadas por cambios unitarios de aminoácidos. Véase archivo de Talk.Origins.
Es obvio que la proporción de objetivos frente a no objetivos puede aumentar, muy espectacularmente, en el espacio de secuencias simplemente rebajando el tamaño mínimo y/o el umbral de especificidad bajo consideración —rebajando con ello el «nivel de complejidad funcional». Algunos tipos de sistemas tienen una especificidad de secuencia o requisitos de tamaños relativamente bajos. Una simple función de enlace —como una secuencia de proteína enlazando con una molécula de ATP, sin ningunos otros requisitos específicos de unión o función, no parece que exija mucha especificidad de secuencia. Y esto es obvio por demostración experimental directa. Sin embargo, muchos otros sistemas funcionales de base proteínica no están tan poco especificados. Se precisa de mucha más secuenciación específica así como tamaño para conseguir las funciones de nivel más elevado. Estas funciones, es obvio, serán mucho menos comunes en el espacio de secuencias y por ello estarán mucho más alejadas, en promedio.
Más específicamente, no se observa generalmente que las estimaciones anteriores derivadas experimentalmente se basan en proteínas con unos requisitos mínimos de tamaño inferiores a 100 residuos aminoácidos bastante especificados (fsaars). Evidentemente, la proporción de objetivos potenciales por debajo del umbral estructural mínimo de 100 fsaars va a ser exponencialmente superior a la proporción por encima de 1.000 fsaars. Esta es realmente la clave para comprender las estimaciones de las proporciones que tantas veces se citan como se menciona más arriba. Estas proporciones son sólo para niveles muy bajos de complejidad funcional que llevan a mucho menos que 1000 fsaars.
Luego se da el argumento de que si se comienza con un genoma funcional intacto, los puntos de partida son más susceptibles de combinarse juntos para producir al menos combinaciones proteínicas estables y que por ello son mucho más susceptibles de acertar también en combinaciones funcionalmente beneficiosas —especialmente cuando se consideran mutaciones de sobrecruzamiento no homólogas y de combinación, así como las mutaciones génicas. Esta es una sugerencia interesante, pero consideremos las probabilidades de este escenario:
Consideremos un ejemplo simple, a modo de ilustración, involucrando un espacio de secuencias de 20aa. ¿Cuántas secuencias estables existen de 20aa? (20ln20)(1/244)(2020) = ~4e16 de entre 1e26 secuencias.
Ahora bien, ¿cuántas combinaciones diferentes de secuencias estables más pequeñas hay que pudieran producir una secuencia de 20aa de ninguna clase? Por ejemplo, ¿cuántas combinaciones diferentes de secuencias estables de 10aa existen? La cantidad total de secuencias estables de 10aa es 20ln10 x 1/222 x 2010 = ~2e9 secuencias diferentes.
De modo que la cantidad total de posibles combinaciones o permutaciones de 2e9, para incluir inserciones así como combos de fin a fin y combos de diferentes longitudes (como secuencias de 3aa + 7aa), es de 2e92 x 11 x 10 = 4,4e20 secuencias. Añadamos a esto la cantidad de mutaciones de sobrecruzamiento no homólogas de secuencias estables de 20aa (1e16 de ellas) y esencialmente se cubre todo el espacio de secuencia de 20aa (~1e26) —que es mucho mayor que la cantidad de secuencias estables de 20aa. En pocas palabras, la cantidad de posibles combinaciones a partir de secuencias viables de 20aa o más cortas exceden inmensamente en número a la cantidad total de secuencias estables de 20aa. Esto significa que la inmensa mayoría de las combinaciones posibles, incluso si se comienza con secuencias viables, que acaban produciendo una secuencia de 20aa no producirá una secuencia viable de 20aa. Lo mismo es esencialmente cierto de un espacio de secuencias para 1000aa.
Así, ¿hay alguna ventaja en comenzar con secuencias viables? En realidad, no ...
Consideremos un trabajo publicado por Blanco et al.18 Este estudio involucraba dos proteínas, el dominio SH3 de la alfa-espectrina (SH3) y el dominio B1 de la proteína estreptocócica G (PG), dos pequeñas proteínas disimilares. Los investigadores intentaron crear proteínas híbridas para moverse gradualmente a través del espacio de secuencias desde la proteína SH3 a la PG mediante mutaciones de sobrecruzamiento no homólogas. Descubrieron que las secuencias intermedias no se plegaban en estructuras estables. Lo que descubrieron fue que incluso cuando añadían la mayor parte de los residuos de la PG a la secuencia de la SH3, a la vez que mantenían los residuos del núcleo de la SH3, la proteína no se plegaba para dar una forma estable. Sólo cuando se extrajeron los residuos del núcleo de la SH3 pudo la secuencia doblarse a la forma de PG. Además, la estructura de la SH3 resultó ser no plegable incluso cuando se mutaban solo dos residuos no pertenecientes al núcleo. Esto implica que el plegado es una característica holista, que exige la cooperación de los residuos hidrófobos del núcleo y los residuos hidrófilos externos al núcleo para especificar la singular estructura de «baja frustración» de una familia proteínica determinada. Además, parece que los residuos de los núcleos de diferentes familias proteínicas pueden en realidad contrarrestarse entre sí, produciendo una proteína inestable no plegada cuando se combinan.
El conjunto de secuencias analizadas aquí son híbridos de las secuencias de SH3 y de PG y representan un muestreo más o menos uniforme de identidades de secuencias entre 100 y ~10% con cada proteína, pero sólo aquellas secuencias muy parecidas a las proteínas de tipo silvestre tienen pliegues específicos.18
La consecuencia es que la nueva proteína hija, para poderse plegar a una forma estable, ha de tener unos residuos hidrófobos y hidrófilos coordinados de forma precisa y que operen juntos para producir una estructura estable. Esto, a su vez, significa que no servirá cualquier proteína de partida —sólo ciertas de ellas que contengan precisamente las secuencias complementarias adecuadas que, cuando se combinen (en la posición correcta en la secuencia), produzcan un pliegue singular estable de la hija. Sin embargo, Bogarad y Deem sostienen que los «intercambios» o sobrecruzamientos son útiles para encontrar novedosos pliegues/familias de proteínas viables.
Demostramos que la mutación génica por sí misma es incapaz de hacer evolucionar sistemas con pliegues proteínicos sustancialmente nuevos. Demostramos además que incluso el método de barajado del ADN es incapaz de hacer evolucionar pliegues proteínicos sustancialmente nuevos. Nuestras simulaciones mediante el método de Monte Carlo demuestran que el barajado de ADN no homólogo de estructuras de baja energía es una etapa crucial en la búsqueda del espacio proteínico.19
Pero Cui et. al. replican observando esto:
Entonces, ¿cuál es el potencial y cuáles son los problemas de las mutaciones por sobrecruzamiento? Véase la sección que sigue sobre «Mutaciones génicas en contraste a Mutaciones por sobrecruzamiento no homólogo».
Como ilustración de esto, consideremos un artículo por Cui et al. (una de cuyas gráficas aparece a continuación):
El final del artículo de Cui demuestra que el beneficio proporcionado por las recombinaciones no homólogas disminuye con el aumento de la escabrosidad (observada en «α» en la gráfica que aparece arriba) del paisaje adaptativo; y un paisaje muy escabroso proporciona sólo un beneficio marginal en comparación con un paisaje menos escabroso. El concepto de «escabrosidad» es una situación en la que los bordes de las islas están marcadamente definidos en comparación con islas con una pendiente más suave en el espacio de secuencias. Como se ilustra en la figura más abajo, la pendiente de las «islas» beneficiosas de secuencias agrupadas en el espacio de secuencias cae «exponencialmente». Los autores analizan las implicaciones de su Fig. 6 (arriba) con las siguientes palabras:
Así, en tanto que hay desde luego una ventaja estadística en el caso de las mutaciones de caracteres múltiples, en la inclusión de mutaciones de sobrecruzamiento así como mutaciones de cortar y pegar, cuando se trata de encontrar islas beneficiosas novedosas en el espacio de secuencias (por encima de las mutaciones génicas), esta ventaja se hace menos y menos considerable a niveles crecientemente superiores de complejidad funcional. Consideremos que en el trabajo de Cui el tamaño máximo de las secuencias proteínicas que se consideraba era de solamente 18 aa. Evidentemente, la densidad de secuencias y/o estructuras beneficiosas respecto a no beneficiosas a este bajísimo nivel va a ser exponencialmente mayor en comparación con un espacio de secuencia de 1000aa cuando se consideren sistemas que exigen al menos un grado de bastante especificidad (como se ha definido más arriba). Además, en tanto que Cui et al. dicen que hay una diferencia «significativa» entre las mutaciones génicas y los sobrecruzamientos, parece que los sobrecruzamientos son sólo alrededor de dos veces mejores que las mutaciones génicas, incluso cuando el paisaje tiene una escabrosidad mínima, para poder encontrar estructuras novedosas viables.
Y, tal como resulta ser, el paisaje adaptativo del espacio de secuencias deviene linealmente más y más «escabroso» con cada larguero que se sube por la escala de la complejidad funcional. De modo que el problema de generar sistemas novedosos y viables de base proteínica sigue siendo tan brutal como siempre —con independencia de si se consideran mutaciones génicas o mutaciones de caracteres múltiples de la clase que sea.
Y, tal como resulta ser, el paisaje adaptativo del espacio de secuencias deviene linealmente más y más «escabroso» con cada larguero que se sube por la escala de la complejidad funcional. De modo que el problema de generar sistemas novedosos y viables de base proteínica sigue siendo tan brutal como siempre —con independencia de si se consideran mutaciones génicas o mutaciones de caracteres múltiples de la clase que sea.
Cuando el paisaje es escabroso, la cantidad de secuencias explorada por las mutaciones génicas solas es comparable con la explorada por las mutaciones génicas junto con sobrecruzamientos [no homólogos]. Esto se debe a que las mutaciones génicas son más eficaces para encontrar un área de baja mortalidad a partir de un punto ya bien poblado en la vecindad, mientras que cuando el paisaje es abrupto lo probable es que mucha de la descendencia de sobrecruzamientos acaben en puntos de mortalidad elevada.17
Así, parece que los paisajes abruptos («cuantificados» funcionalmente) son paralizantes tanto respecto de las mutaciones génicas como de los sobrecruzamientos o de las mutaciones de caracteres múltiples —hasta el mismo punto, básicamente, cuando se supera un cierto nivel de «escabrosidad» del paisaje. Esto se debe a que es mucho más probable que una etapa grande, como un sobrecruzamiento no homólogo, produzca una secuencia no plegable, no funcional, que a una secuencia plegada, funcional. Lo que sospecho que sucede es que los requisitos para un plegado estable se están volviendo tan estrictos que las probabilidades son sencillamente demasiado bajas para que la recombinación logre nada. En otras palabras, quizá una o más de las secuencias originarias no están presentes, o la probabilidad es sencillamente demasiado pequeña para que se recombinen las dos adecuadas de la manera precisamente adecuada para producir una secuencia derivada funcional. El hecho de que los requisitos de plegado de las proteínas son en verdad muy estrictos está bien respaldado en la literatura —lo mismo que el concepto de que con cada incremento en el tamaño mínimo y/o en la especificidad de los sistemas en cuestión, la penuria de secuencias viables aumenta exponencialmente.

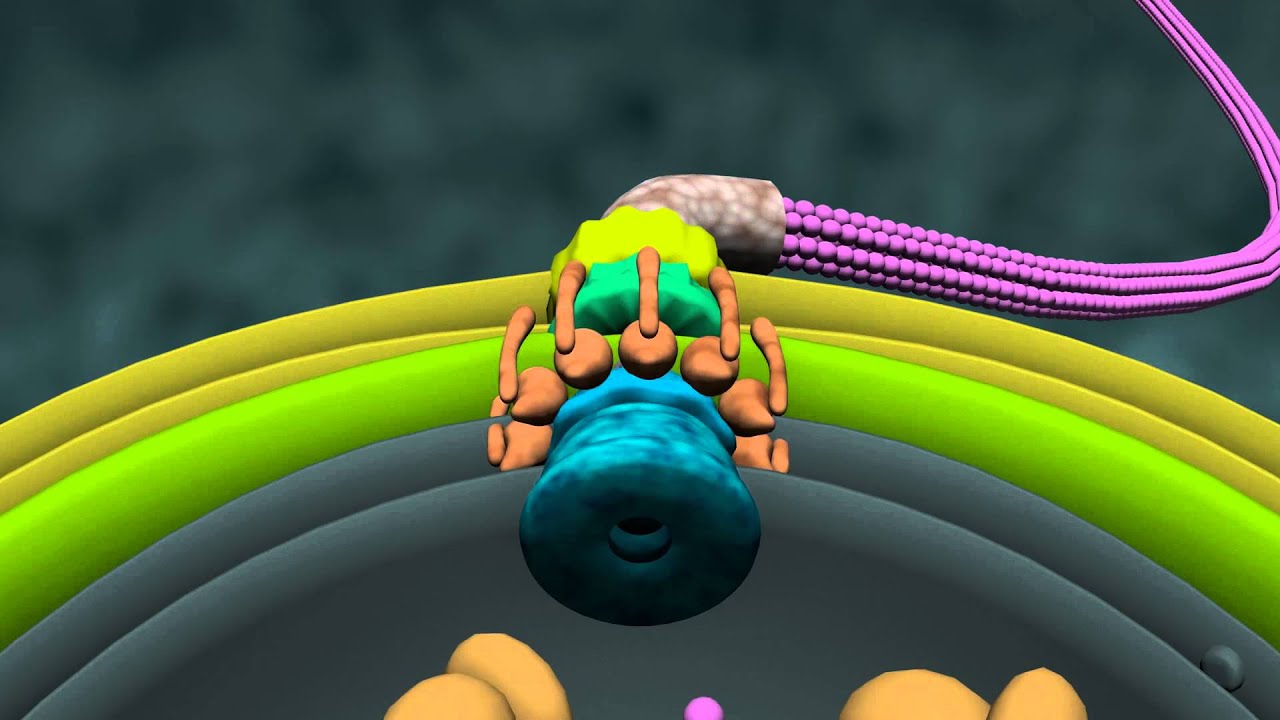
Publicar un comentario